Eine Verdünnung in der Chemie ist ein Prozess, der die Konzentration einer Substanz in einer Lösung reduziert. Eine serielle Verdünnung ist die wiederholte Verdünnung einer Lösung, um den Verdünnungsfaktor schnell zu verstärken.[1] Dies wird üblicherweise in Experimenten durchgeführt, die stark verdünnte Lösungen erfordern, z. B. solche mit Konzentrationskurven auf logarithmischer Skala oder wenn Sie die Dichte von Bakterien bestimmen. Serielle Verdünnungen werden häufig in experimentellen Wissenschaften wie Biochemie, Mikrobiologie, Pharmakologie und Physik verwendet.
Methode eins von zwei:
Eine grundlegende Verdünnung durchführen
-
 1 Ermitteln Sie die richtige Verdünnungsflüssigkeit. Die Flüssigkeit, in der du deine Substanz verdünnst, ist sehr wichtig. Viele Lösungen werden in destilliertem Wasser verdünnt, aber das ist nicht immer der Fall. Wenn Sie Bakterien oder andere Zellen verdünnen, werden Sie wahrscheinlich in Kulturmedien verdünnen wollen.[2] Die von Ihnen gewählte Flüssigkeit wird für jede Verdünnungsreihe verwendet.
1 Ermitteln Sie die richtige Verdünnungsflüssigkeit. Die Flüssigkeit, in der du deine Substanz verdünnst, ist sehr wichtig. Viele Lösungen werden in destilliertem Wasser verdünnt, aber das ist nicht immer der Fall. Wenn Sie Bakterien oder andere Zellen verdünnen, werden Sie wahrscheinlich in Kulturmedien verdünnen wollen.[2] Die von Ihnen gewählte Flüssigkeit wird für jede Verdünnungsreihe verwendet. - Wenn Sie sich nicht sicher sind, welche Flüssigkeit Sie verwenden sollen, fragen Sie nach Hilfe oder überprüfen Sie online, ob andere Personen eine ähnliche Verdünnung durchgeführt haben.
-
 2 Bereiten Sie mehrere Reagenzgläser mit 9 ml Verdünnungsflüssigkeit vor. Diese Röhrchen dienen als Verdünnungsrohlinge.[3] Sie geben Ihre unverdünnte Probe in die erste Röhre und verdünnen sie dann nacheinander in die folgenden Röhrchen.
2 Bereiten Sie mehrere Reagenzgläser mit 9 ml Verdünnungsflüssigkeit vor. Diese Röhrchen dienen als Verdünnungsrohlinge.[3] Sie geben Ihre unverdünnte Probe in die erste Röhre und verdünnen sie dann nacheinander in die folgenden Röhrchen. - Es ist hilfreich, alle Tuben zu kennzeichnen, bevor Sie beginnen, damit Sie nicht verwirrt werden, wenn Sie mit den Verdünnungen beginnen.
- Jedes Röhrchen wird eine 10-fache Verdünnung ausgehend von dem unverdünnten Röhrchen sein.[4] Die erste Tube wird eine 1:10 Verdünnung sein, die zweite eine 1: 100, die dritte eine 1: 1000, usw. Bestimmen Sie die Anzahl der Verdünnungen, die Sie vorher tun müssen, damit Sie keine Röhrchen oder Verdünnungsflüssigkeit verschwenden.
-
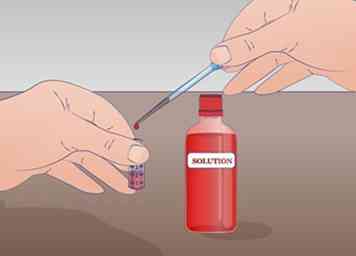 3 Bereiten Sie ein Reagenzglas mit mindestens 2 ml Ihrer unverdünnten Lösung vor. Die minimale Menge, die benötigt wird, um diese serielle Verdünnung durchzuführen, ist 1 ml unverdünnter Lösung. Wenn Sie nur 1 ml haben, haben Sie keine unverdünnte Lösung. Beschrifte diese Röhre UNS für unverdünnte Lösung.
3 Bereiten Sie ein Reagenzglas mit mindestens 2 ml Ihrer unverdünnten Lösung vor. Die minimale Menge, die benötigt wird, um diese serielle Verdünnung durchzuführen, ist 1 ml unverdünnter Lösung. Wenn Sie nur 1 ml haben, haben Sie keine unverdünnte Lösung. Beschrifte diese Röhre UNS für unverdünnte Lösung. - Mischen Sie Ihre Lösung gründlich, bevor Sie Verdünnungen beginnen.[5]
-
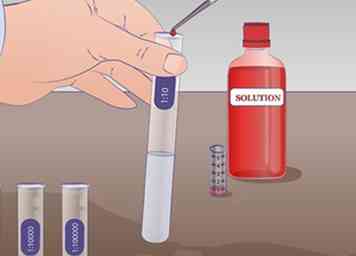 4 Führen Sie die erste Verdünnung durch. 1 ml unverdünnte Lösung aus dem Reagenzglas ziehen UNS mit einer Pipette und übertragen Sie es auf das Reagenzglas mit der Aufschrift 1:10 enthält 9 ml der Verdünnungsflüssigkeit und mischt gründlich. Es gibt jetzt 1 ml der unverdünnten Lösung in 9 ml der Verdünnungsflüssigkeit. Die Lösung wurde daher um den Faktor 10 verdünnt.
4 Führen Sie die erste Verdünnung durch. 1 ml unverdünnte Lösung aus dem Reagenzglas ziehen UNS mit einer Pipette und übertragen Sie es auf das Reagenzglas mit der Aufschrift 1:10 enthält 9 ml der Verdünnungsflüssigkeit und mischt gründlich. Es gibt jetzt 1 ml der unverdünnten Lösung in 9 ml der Verdünnungsflüssigkeit. Die Lösung wurde daher um den Faktor 10 verdünnt. -
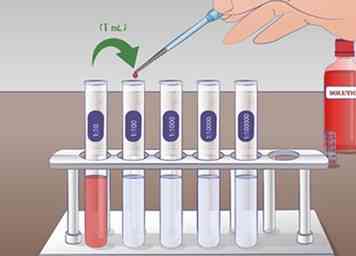 5 Führen Sie die zweite Verdünnung durch. Für die zweite serielle Verdünnung nehmen Sie 1 ml Lösung aus dem Röhrchen 1:10 und füge es zu den 9 ml Verdünnungsflüssigkeit in dem Röhrchen hinzu 1:100. Rohr gründlich mischen 1:10 vor dem Hinzufügen zur nächsten Röhre. Mischen Sie die Röhre erneut 1:100 folgende Verdünnung. Die Lösung aus dem Reagenzglas 1:10 wurde 10-fach in ein Reagenzglas verdünnt 1:100.
5 Führen Sie die zweite Verdünnung durch. Für die zweite serielle Verdünnung nehmen Sie 1 ml Lösung aus dem Röhrchen 1:10 und füge es zu den 9 ml Verdünnungsflüssigkeit in dem Röhrchen hinzu 1:100. Rohr gründlich mischen 1:10 vor dem Hinzufügen zur nächsten Röhre. Mischen Sie die Röhre erneut 1:100 folgende Verdünnung. Die Lösung aus dem Reagenzglas 1:10 wurde 10-fach in ein Reagenzglas verdünnt 1:100. -
 6 Erweitern Sie diesen Vorgang, um längere serielle Verdünnungen durchzuführen. Dieser Prozess kann so oft wie nötig wiederholt werden, um die gewünschte Lösung zu erreichen. In einem Experiment mit Konzentrationskurven können Sie eine serielle Verdünnung verwenden, um eine Reihe von Lösungen mit Verdünnungen von 1, 1:10, 1: 100, 1: 1.000 zu erstellen.
6 Erweitern Sie diesen Vorgang, um längere serielle Verdünnungen durchzuführen. Dieser Prozess kann so oft wie nötig wiederholt werden, um die gewünschte Lösung zu erreichen. In einem Experiment mit Konzentrationskurven können Sie eine serielle Verdünnung verwenden, um eine Reihe von Lösungen mit Verdünnungen von 1, 1:10, 1: 100, 1: 1.000 zu erstellen.
Methode zwei von zwei:
Berechnung des endgültigen Verdünnungsfaktors und der Konzentration
-
 1 Berechnen Sie das endgültige Verdünnungsverhältnis in einer seriellen Verdünnung. Das Gesamtverdünnungsverhältnis kann durch Multiplizieren des Verdünnungsfaktors jedes Schritts, der zu dem Endschritt führt, bestimmt werden. Dies kann mathematisch mit der Gleichung veranschaulicht werden Dt = D1 x D2 x D3 x ... x Dn woher Dt ist der Gesamtverdünnungsfaktor und Dn ist das Verdünnungsverhältnis.[6]
1 Berechnen Sie das endgültige Verdünnungsverhältnis in einer seriellen Verdünnung. Das Gesamtverdünnungsverhältnis kann durch Multiplizieren des Verdünnungsfaktors jedes Schritts, der zu dem Endschritt führt, bestimmt werden. Dies kann mathematisch mit der Gleichung veranschaulicht werden Dt = D1 x D2 x D3 x ... x Dn woher Dt ist der Gesamtverdünnungsfaktor und Dn ist das Verdünnungsverhältnis.[6] - Nehmen wir zum Beispiel an, du hättest eine 1: 10-Verdünnung deiner Flüssigkeit 4 mal gemacht. Stecke deinen Verdünnungsfaktor in die Gleichung: Dt = 10 x 10 x 10 x 10 = 10.000
- Der Endverdünnungsfaktor des vierten Röhrchens in der Serienverdünnung beträgt 1: 10.000. Die Konzentration Ihrer Substanz ist jetzt 10.000 Mal geringer als die der ursprünglichen unverdünnten Lösung.
-
 2 Bestimmen Sie die Konzentration der Lösung nach der Verdünnung. Um die Endkonzentration Ihrer Lösung nach der Verdünnungsreihe zu bestimmen, müssen Sie Ihre Anfangskonzentration kennen. Die Gleichung ist CFinale = CInitiale/ D woher CFinale ist die Endkonzentration der verdünnten Lösung, CInitiale ist die Ausgangskonzentration der ursprünglichen Lösung und D ist das zuvor bestimmte Verdünnungsverhältnis.[7]
2 Bestimmen Sie die Konzentration der Lösung nach der Verdünnung. Um die Endkonzentration Ihrer Lösung nach der Verdünnungsreihe zu bestimmen, müssen Sie Ihre Anfangskonzentration kennen. Die Gleichung ist CFinale = CInitiale/ D woher CFinale ist die Endkonzentration der verdünnten Lösung, CInitiale ist die Ausgangskonzentration der ursprünglichen Lösung und D ist das zuvor bestimmte Verdünnungsverhältnis.[7] - Zum Beispiel: Wenn Sie mit einer Lösung von Zellen mit einer Konzentration von 1.000.000 Zellen pro ml begonnen haben und Ihr Verdünnungsverhältnis 1.000 ist, wie ist die Endkonzentration Ihrer verdünnten Probe?
- Verwenden der Gleichung:
- CFinale = CInitiale/ D
- CFinale = 1,000,000/1,000
- CFinale = 1.000 Zellen pro ml.
-
 3 Bestätigen Sie, dass alle Einheiten übereinstimmen. Wenn Sie eine Berechnung durchführen, möchten Sie sicherstellen, dass Ihre Einheiten immer am Ende übereinstimmen.[8] Wenn Sie mit Zellen pro ml begonnen haben, stellen Sie sicher, dass Sie mit Zellen pro ml enden. Wenn Ihre Ausgangskonzentration Teile pro Million (ppm) ist, muss Ihre Endkonzentration ppm sein.
3 Bestätigen Sie, dass alle Einheiten übereinstimmen. Wenn Sie eine Berechnung durchführen, möchten Sie sicherstellen, dass Ihre Einheiten immer am Ende übereinstimmen.[8] Wenn Sie mit Zellen pro ml begonnen haben, stellen Sie sicher, dass Sie mit Zellen pro ml enden. Wenn Ihre Ausgangskonzentration Teile pro Million (ppm) ist, muss Ihre Endkonzentration ppm sein.
 Minotauromaquia
Minotauromaquia
 1 Ermitteln Sie die richtige Verdünnungsflüssigkeit. Die Flüssigkeit, in der du deine Substanz verdünnst, ist sehr wichtig. Viele Lösungen werden in destilliertem Wasser verdünnt, aber das ist nicht immer der Fall. Wenn Sie Bakterien oder andere Zellen verdünnen, werden Sie wahrscheinlich in Kulturmedien verdünnen wollen.[2] Die von Ihnen gewählte Flüssigkeit wird für jede Verdünnungsreihe verwendet.
1 Ermitteln Sie die richtige Verdünnungsflüssigkeit. Die Flüssigkeit, in der du deine Substanz verdünnst, ist sehr wichtig. Viele Lösungen werden in destilliertem Wasser verdünnt, aber das ist nicht immer der Fall. Wenn Sie Bakterien oder andere Zellen verdünnen, werden Sie wahrscheinlich in Kulturmedien verdünnen wollen.[2] Die von Ihnen gewählte Flüssigkeit wird für jede Verdünnungsreihe verwendet.  2 Bereiten Sie mehrere Reagenzgläser mit 9 ml Verdünnungsflüssigkeit vor. Diese Röhrchen dienen als Verdünnungsrohlinge.[3] Sie geben Ihre unverdünnte Probe in die erste Röhre und verdünnen sie dann nacheinander in die folgenden Röhrchen.
2 Bereiten Sie mehrere Reagenzgläser mit 9 ml Verdünnungsflüssigkeit vor. Diese Röhrchen dienen als Verdünnungsrohlinge.[3] Sie geben Ihre unverdünnte Probe in die erste Röhre und verdünnen sie dann nacheinander in die folgenden Röhrchen.  3 Bereiten Sie ein Reagenzglas mit mindestens 2 ml Ihrer unverdünnten Lösung vor. Die minimale Menge, die benötigt wird, um diese serielle Verdünnung durchzuführen, ist 1 ml unverdünnter Lösung. Wenn Sie nur 1 ml haben, haben Sie keine unverdünnte Lösung. Beschrifte diese Röhre UNS für unverdünnte Lösung.
3 Bereiten Sie ein Reagenzglas mit mindestens 2 ml Ihrer unverdünnten Lösung vor. Die minimale Menge, die benötigt wird, um diese serielle Verdünnung durchzuführen, ist 1 ml unverdünnter Lösung. Wenn Sie nur 1 ml haben, haben Sie keine unverdünnte Lösung. Beschrifte diese Röhre UNS für unverdünnte Lösung.  4 Führen Sie die erste Verdünnung durch. 1 ml unverdünnte Lösung aus dem Reagenzglas ziehen UNS mit einer Pipette und übertragen Sie es auf das Reagenzglas mit der Aufschrift 1:10 enthält 9 ml der Verdünnungsflüssigkeit und mischt gründlich. Es gibt jetzt 1 ml der unverdünnten Lösung in 9 ml der Verdünnungsflüssigkeit. Die Lösung wurde daher um den Faktor 10 verdünnt.
4 Führen Sie die erste Verdünnung durch. 1 ml unverdünnte Lösung aus dem Reagenzglas ziehen UNS mit einer Pipette und übertragen Sie es auf das Reagenzglas mit der Aufschrift 1:10 enthält 9 ml der Verdünnungsflüssigkeit und mischt gründlich. Es gibt jetzt 1 ml der unverdünnten Lösung in 9 ml der Verdünnungsflüssigkeit. Die Lösung wurde daher um den Faktor 10 verdünnt.  5 Führen Sie die zweite Verdünnung durch. Für die zweite serielle Verdünnung nehmen Sie 1 ml Lösung aus dem Röhrchen 1:10 und füge es zu den 9 ml Verdünnungsflüssigkeit in dem Röhrchen hinzu 1:100. Rohr gründlich mischen 1:10 vor dem Hinzufügen zur nächsten Röhre. Mischen Sie die Röhre erneut 1:100 folgende Verdünnung. Die Lösung aus dem Reagenzglas 1:10 wurde 10-fach in ein Reagenzglas verdünnt 1:100.
5 Führen Sie die zweite Verdünnung durch. Für die zweite serielle Verdünnung nehmen Sie 1 ml Lösung aus dem Röhrchen 1:10 und füge es zu den 9 ml Verdünnungsflüssigkeit in dem Röhrchen hinzu 1:100. Rohr gründlich mischen 1:10 vor dem Hinzufügen zur nächsten Röhre. Mischen Sie die Röhre erneut 1:100 folgende Verdünnung. Die Lösung aus dem Reagenzglas 1:10 wurde 10-fach in ein Reagenzglas verdünnt 1:100.  6 Erweitern Sie diesen Vorgang, um längere serielle Verdünnungen durchzuführen. Dieser Prozess kann so oft wie nötig wiederholt werden, um die gewünschte Lösung zu erreichen. In einem Experiment mit Konzentrationskurven können Sie eine serielle Verdünnung verwenden, um eine Reihe von Lösungen mit Verdünnungen von 1, 1:10, 1: 100, 1: 1.000 zu erstellen.
6 Erweitern Sie diesen Vorgang, um längere serielle Verdünnungen durchzuführen. Dieser Prozess kann so oft wie nötig wiederholt werden, um die gewünschte Lösung zu erreichen. In einem Experiment mit Konzentrationskurven können Sie eine serielle Verdünnung verwenden, um eine Reihe von Lösungen mit Verdünnungen von 1, 1:10, 1: 100, 1: 1.000 zu erstellen.  1 Berechnen Sie das endgültige Verdünnungsverhältnis in einer seriellen Verdünnung. Das Gesamtverdünnungsverhältnis kann durch Multiplizieren des Verdünnungsfaktors jedes Schritts, der zu dem Endschritt führt, bestimmt werden. Dies kann mathematisch mit der Gleichung veranschaulicht werden Dt = D1 x D2 x D3 x ... x Dn woher Dt ist der Gesamtverdünnungsfaktor und Dn ist das Verdünnungsverhältnis.[6]
1 Berechnen Sie das endgültige Verdünnungsverhältnis in einer seriellen Verdünnung. Das Gesamtverdünnungsverhältnis kann durch Multiplizieren des Verdünnungsfaktors jedes Schritts, der zu dem Endschritt führt, bestimmt werden. Dies kann mathematisch mit der Gleichung veranschaulicht werden Dt = D1 x D2 x D3 x ... x Dn woher Dt ist der Gesamtverdünnungsfaktor und Dn ist das Verdünnungsverhältnis.[6]  2 Bestimmen Sie die Konzentration der Lösung nach der Verdünnung. Um die Endkonzentration Ihrer Lösung nach der Verdünnungsreihe zu bestimmen, müssen Sie Ihre Anfangskonzentration kennen. Die Gleichung ist CFinale = CInitiale/ D woher CFinale ist die Endkonzentration der verdünnten Lösung, CInitiale ist die Ausgangskonzentration der ursprünglichen Lösung und D ist das zuvor bestimmte Verdünnungsverhältnis.[7]
2 Bestimmen Sie die Konzentration der Lösung nach der Verdünnung. Um die Endkonzentration Ihrer Lösung nach der Verdünnungsreihe zu bestimmen, müssen Sie Ihre Anfangskonzentration kennen. Die Gleichung ist CFinale = CInitiale/ D woher CFinale ist die Endkonzentration der verdünnten Lösung, CInitiale ist die Ausgangskonzentration der ursprünglichen Lösung und D ist das zuvor bestimmte Verdünnungsverhältnis.[7]  3 Bestätigen Sie, dass alle Einheiten übereinstimmen. Wenn Sie eine Berechnung durchführen, möchten Sie sicherstellen, dass Ihre Einheiten immer am Ende übereinstimmen.[8] Wenn Sie mit Zellen pro ml begonnen haben, stellen Sie sicher, dass Sie mit Zellen pro ml enden. Wenn Ihre Ausgangskonzentration Teile pro Million (ppm) ist, muss Ihre Endkonzentration ppm sein.
3 Bestätigen Sie, dass alle Einheiten übereinstimmen. Wenn Sie eine Berechnung durchführen, möchten Sie sicherstellen, dass Ihre Einheiten immer am Ende übereinstimmen.[8] Wenn Sie mit Zellen pro ml begonnen haben, stellen Sie sicher, dass Sie mit Zellen pro ml enden. Wenn Ihre Ausgangskonzentration Teile pro Million (ppm) ist, muss Ihre Endkonzentration ppm sein.