Die Benennung chemischer Grundchemikalien ist essentiell, wenn Sie in der Chemie erfolgreich sein wollen, da der Name der Verbindung klar definiert, was es ist. Jede Art von Verbindung hat ihre eigenen Regeln, um sie zu benennen. Wenn Sie Verbindungen benennen, müssen Sie diese verschiedenen Regeln verstehen und Hinweise finden, die Ihnen helfen, die Verbindungen richtig zu benennen. Befolgen Sie diese Anleitung für einige grundlegende Regeln, wie chemische Verbindungen ihren Namen erhalten und wie Sie Namen auf Verbindungen anwenden, mit denen Sie nicht vertraut sind.
Methode eins von dreien:
Benennung ionischer Verbindungen
-
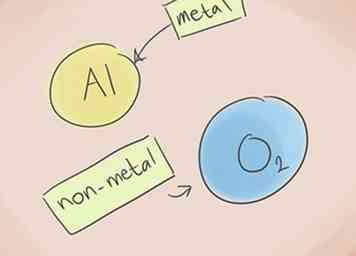 1 Wissen, was eine Verbindung ionisch macht. Ionische Verbindungen enthalten ein Metall und ein Nichtmetall. Sehen Sie im Periodensystem der Elemente nach, zu welchen Kategorien die Elemente in der Verbindung gehören.[1]
1 Wissen, was eine Verbindung ionisch macht. Ionische Verbindungen enthalten ein Metall und ein Nichtmetall. Sehen Sie im Periodensystem der Elemente nach, zu welchen Kategorien die Elemente in der Verbindung gehören.[1] -
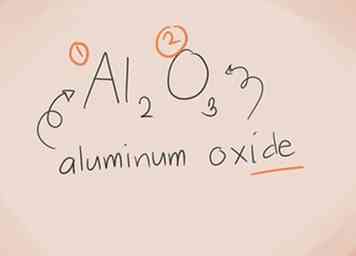 2 Erstellen Sie den Namen. Für eine ionische Verbindung mit zwei Elementen ist die Benennung einfach. Der erste Teil des Namens ist der Name des Metallelements. Der zweite Teil ist der Name des Nichtmetallelements mit dem Suffix "-ide".[2]
2 Erstellen Sie den Namen. Für eine ionische Verbindung mit zwei Elementen ist die Benennung einfach. Der erste Teil des Namens ist der Name des Metallelements. Der zweite Teil ist der Name des Nichtmetallelements mit dem Suffix "-ide".[2] - Hier sind einige Beispiele:
- Al2O3. Al2 = Aluminium; O3 = Sauerstoff. Also wäre der Name "Aluminiumoxid".
- FeCl3. Fe = Eisen; Cl3 = Chlor. Also wäre der Name "Eisenchlorid".
- SnO2. Sn = Zinn; O2 = Sauerstoff. Der Name dieser Verbindung wäre also Zinnoxid.
- Hier sind einige Beispiele:
-
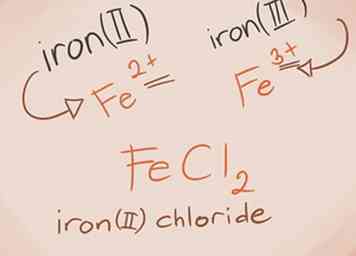 3 Erkennen und benennen Sie Übergangsmetalle. Metalle in den D- und F-Blöcken des Periodensystems sind als Übergangsmetalle bekannt. Ihre Ladung wird mit einer römischen Zahl geschrieben, wenn der zusammengesetzte Name geschrieben wird. Dies liegt daran, dass sie mehr als eine Ladung haben und mehr als eine Verbindung herstellen können.[3]
3 Erkennen und benennen Sie Übergangsmetalle. Metalle in den D- und F-Blöcken des Periodensystems sind als Übergangsmetalle bekannt. Ihre Ladung wird mit einer römischen Zahl geschrieben, wenn der zusammengesetzte Name geschrieben wird. Dies liegt daran, dass sie mehr als eine Ladung haben und mehr als eine Verbindung herstellen können.[3] - Beispiel: FeCl2 und FeCl3. Fe = Eisen; Cl2 = Chlorid -2; Cl3 = Chlorid -3. Die Namen wären Eisen (II) -chlorid und Eisen (III) -chlorid.
Methode zwei von drei:
Mehratomige Verbindungen benennen
-
 1 Verstehen Sie, was eine mehratomige Verbindung ist. Diese Verbindungen sind aus Gruppen von Atomen aufgebaut, die kovalent miteinander verbunden sind, und die gesamte Gruppe hat eine positive oder negative Ladung.[4] Sie können polyatomaren Verbindungen drei grundlegende Dinge zuweisen, die Ihnen helfen, diese Arten von Verbindungen zu identifizieren und zu verstehen:
1 Verstehen Sie, was eine mehratomige Verbindung ist. Diese Verbindungen sind aus Gruppen von Atomen aufgebaut, die kovalent miteinander verbunden sind, und die gesamte Gruppe hat eine positive oder negative Ladung.[4] Sie können polyatomaren Verbindungen drei grundlegende Dinge zuweisen, die Ihnen helfen, diese Arten von Verbindungen zu identifizieren und zu verstehen: - Füge einen Wasserstoff am Anfang der Verbindung hinzu. Das Wort "Wasserstoff" wird am Anfang des zusammengesetzten Namens hinzugefügt. Dies reduziert die negative Ladung um eins. Zum Beispiel "Carbonat" CO32- wird "Hydrogencarbonat" HCO3-.

- Entfernen Sie einen Sauerstoff aus der Verbindung. Die Ladung bleibt gleich und das Ende der Verbindung wechselt von "-ate" zu "-ite". Zum Beispiel: NEIN3 zu NEIN2 geht von "Nitrat" zu "Nitrit".

- Ersetzen Sie das Zentralatom durch ein anderes aus derselben periodischen Gruppe. Zum Beispiel Sulfat SO42- kann Selenate SeO werden42-.
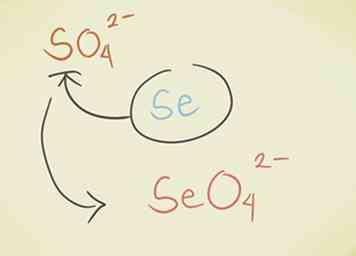
- Füge einen Wasserstoff am Anfang der Verbindung hinzu. Das Wort "Wasserstoff" wird am Anfang des zusammengesetzten Namens hinzugefügt. Dies reduziert die negative Ladung um eins. Zum Beispiel "Carbonat" CO32- wird "Hydrogencarbonat" HCO3-.
-
 2 Merken Sie sich die häufigsten Ionengruppen. Dies sind die Grundlagen für die Bildung der meisten mehratomigen Verbindungen. In der Reihenfolge der zunehmenden negativen Ladung aufgelistet, sind sie:
2 Merken Sie sich die häufigsten Ionengruppen. Dies sind die Grundlagen für die Bildung der meisten mehratomigen Verbindungen. In der Reihenfolge der zunehmenden negativen Ladung aufgelistet, sind sie: - Hydroxydion: OH-
- Nitration: NO3-
- Hydrogencarbonat-Ion: HCO3-
- Permanganation: MnO4-
- Carbonation: CO32-
- Chromation: CrO42-
- Dichromat-Ion: Cr2O72-
- Sulfatation: SO42-
- Sulfition: SO32-
- Thiosulfation: S2O3<2-
- Phosphation: PO43-
- Ammoniumion: NH4+
- 3 Erstellen Sie zusammengesetzte Namen basierend auf der Liste. Assoziieren Sie alle Elemente, die an die Gruppe angehängt sind, und benennen Sie sie entsprechend. Wenn das Element vor die Ionengruppe tritt, wird der Name des Elements einfach an den Anfang des zusammengesetzten Namens angehängt.
- Beispiel: KMnO4. Sie sollten das MnO erkennen4- Ion als Permanganat. K ist Kalium, daher wird die Verbindung Kaliumpermanganat genannt.

- Beispiel: NaOH. Sie sollten das OH erkennen- Ion als Hydroxid. Na ist Natrium, daher wird die Verbindung Natriumhydroxid genannt.
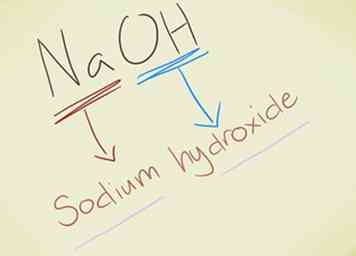
- Beispiel: KMnO4. Sie sollten das MnO erkennen4- Ion als Permanganat. K ist Kalium, daher wird die Verbindung Kaliumpermanganat genannt.
Methode drei von drei:
Benennung kovalenter Verbindungen
-
 1 Verstehen Sie eine kovalente Verbindung. Kovalente Verbindungen werden von zwei oder mehr Nichtmetallelementen gebildet. Der Name für die Verbindung basiert darauf, wie viele Atome vorhanden sind. Das Präfix ist der lateinische Ausdruck für die Anzahl der Moleküle.
1 Verstehen Sie eine kovalente Verbindung. Kovalente Verbindungen werden von zwei oder mehr Nichtmetallelementen gebildet. Der Name für die Verbindung basiert darauf, wie viele Atome vorhanden sind. Das Präfix ist der lateinische Ausdruck für die Anzahl der Moleküle. -
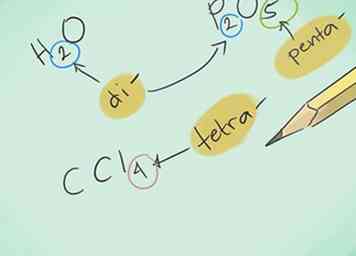 2 Lerne die Präfixe. Merken Sie sich die Präfixe für bis zu 10 Atome:
2 Lerne die Präfixe. Merken Sie sich die Präfixe für bis zu 10 Atome: - 1 Atom - "Mono-"
- 2 Atome - "Di-"
- 3 Atome - "Tri-"
- 4 Atome - "Tetra-"
- 5 Atome - "Penta-"
- 6 Atome - "Hexa-"
- 7 Atome - "Hepta"
- 8 Atome - "Octa-"
- 9 Atome - "Nona-"
- 10 Atome - "Deca-"
- 3 Benenne die Verbindungen. Benennen Sie die neue Verbindung mit den richtigen Präfixen. Sie fügen jedem Teil der Verbindung, der mehrere Atome enthält, Präfixe zu.
- Beispiel: CO wäre Kohlenmonoxid und CO2 wäre Kohlendioxid.

- Beispiel: N2S3 wäre Distickstofftrisulfid.
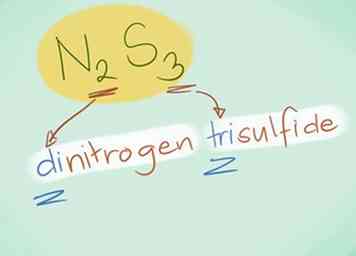
- In den meisten Fällen kann das Präfix "mono" weggelassen werden, weil es impliziert wird, wenn es nicht vorhanden ist. Es wird immer noch für Kohlenmonoxid verwendet, da der Begriff seit der frühen Chemie verwendet wird.

- Beispiel: CO wäre Kohlenmonoxid und CO2 wäre Kohlendioxid.
Facebook
Twitter
Google+
 Minotauromaquia
Minotauromaquia
 1 Wissen, was eine Verbindung ionisch macht. Ionische Verbindungen enthalten ein Metall und ein Nichtmetall. Sehen Sie im Periodensystem der Elemente nach, zu welchen Kategorien die Elemente in der Verbindung gehören.[1]
1 Wissen, was eine Verbindung ionisch macht. Ionische Verbindungen enthalten ein Metall und ein Nichtmetall. Sehen Sie im Periodensystem der Elemente nach, zu welchen Kategorien die Elemente in der Verbindung gehören.[1] 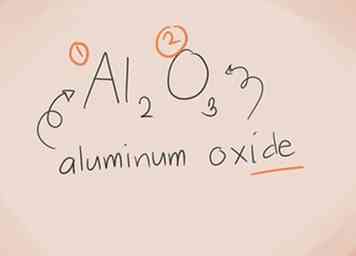 2 Erstellen Sie den Namen. Für eine ionische Verbindung mit zwei Elementen ist die Benennung einfach. Der erste Teil des Namens ist der Name des Metallelements. Der zweite Teil ist der Name des Nichtmetallelements mit dem Suffix "-ide".[2]
2 Erstellen Sie den Namen. Für eine ionische Verbindung mit zwei Elementen ist die Benennung einfach. Der erste Teil des Namens ist der Name des Metallelements. Der zweite Teil ist der Name des Nichtmetallelements mit dem Suffix "-ide".[2] 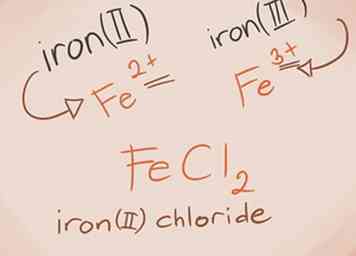 3 Erkennen und benennen Sie Übergangsmetalle. Metalle in den D- und F-Blöcken des Periodensystems sind als Übergangsmetalle bekannt. Ihre Ladung wird mit einer römischen Zahl geschrieben, wenn der zusammengesetzte Name geschrieben wird. Dies liegt daran, dass sie mehr als eine Ladung haben und mehr als eine Verbindung herstellen können.[3]
3 Erkennen und benennen Sie Übergangsmetalle. Metalle in den D- und F-Blöcken des Periodensystems sind als Übergangsmetalle bekannt. Ihre Ladung wird mit einer römischen Zahl geschrieben, wenn der zusammengesetzte Name geschrieben wird. Dies liegt daran, dass sie mehr als eine Ladung haben und mehr als eine Verbindung herstellen können.[3]  1 Verstehen Sie, was eine mehratomige Verbindung ist. Diese Verbindungen sind aus Gruppen von Atomen aufgebaut, die kovalent miteinander verbunden sind, und die gesamte Gruppe hat eine positive oder negative Ladung.[4] Sie können polyatomaren Verbindungen drei grundlegende Dinge zuweisen, die Ihnen helfen, diese Arten von Verbindungen zu identifizieren und zu verstehen:
1 Verstehen Sie, was eine mehratomige Verbindung ist. Diese Verbindungen sind aus Gruppen von Atomen aufgebaut, die kovalent miteinander verbunden sind, und die gesamte Gruppe hat eine positive oder negative Ladung.[4] Sie können polyatomaren Verbindungen drei grundlegende Dinge zuweisen, die Ihnen helfen, diese Arten von Verbindungen zu identifizieren und zu verstehen: 


 2 Merken Sie sich die häufigsten Ionengruppen. Dies sind die Grundlagen für die Bildung der meisten mehratomigen Verbindungen. In der Reihenfolge der zunehmenden negativen Ladung aufgelistet, sind sie:
2 Merken Sie sich die häufigsten Ionengruppen. Dies sind die Grundlagen für die Bildung der meisten mehratomigen Verbindungen. In der Reihenfolge der zunehmenden negativen Ladung aufgelistet, sind sie: 

 1 Verstehen Sie eine kovalente Verbindung. Kovalente Verbindungen werden von zwei oder mehr Nichtmetallelementen gebildet. Der Name für die Verbindung basiert darauf, wie viele Atome vorhanden sind. Das Präfix ist der lateinische Ausdruck für die Anzahl der Moleküle.
1 Verstehen Sie eine kovalente Verbindung. Kovalente Verbindungen werden von zwei oder mehr Nichtmetallelementen gebildet. Der Name für die Verbindung basiert darauf, wie viele Atome vorhanden sind. Das Präfix ist der lateinische Ausdruck für die Anzahl der Moleküle.  2 Lerne die Präfixe. Merken Sie sich die Präfixe für bis zu 10 Atome:
2 Lerne die Präfixe. Merken Sie sich die Präfixe für bis zu 10 Atome: 

