In der Chemie ist ein Molekül kovalent wenn es aus Bindungen zwischen Nichtmetallen gebildet wird.[1] Um diese Arten von Verbindungen zu benennen, ist es normalerweise wichtig, die Namen der Atome im Molekül sowie die Anzahl der Atome zu kennen. Bestimmte spezielle Regeln existieren für Säuren und verwandte Verbindungen, die typischerweise durch die Gegenwart eines oder mehrerer Wasserstoffatome am Anfang der Formel der Verbindung erkannt werden.
Methode eins von dreien:
Erlernen numerischer Präfixe für kovalente Verbindungen
| Nummer | Griechisches Präfix | Beispiel |
|---|---|---|
| 1 | Mono- | Kohlenstoff Monoxide (CO) |
| 2 | Di- | Kohlenstoff diOxid (CO2) |
| 3 | Tri- | Phosphor triHydrid (PH3) |
| 4 | Tetra- | Silizium tetraFluorid (SiF4) |
| 5 | Penta- | Distickstoff pentOxid (N2O5) |
| 6 | Hexa- | Schwefel HexaChlorid (SCl6) |
| 7 | Hepta | Jod HeptaFluorid (IF7) |
| 8 | Octa- | Tetranitrogen OktaChlorid (N4Cl8) |
Methode zwei von drei:
Benennung basischer binärer Verbindungen
-
 1 Benennen Sie das erste Element in der Verbindung. Molekulare Formeln werden wie englische Wörter von links nach rechts gelesen. Im Allgemeinen ist das erste Atom (die 1 auf der linken Seite der Molekülformel) auch das am wenigsten reichlich vorhandene Atom in der Verbindung. Schreiben Sie zuerst den Namen dieses Atoms.
1 Benennen Sie das erste Element in der Verbindung. Molekulare Formeln werden wie englische Wörter von links nach rechts gelesen. Im Allgemeinen ist das erste Atom (die 1 auf der linken Seite der Molekülformel) auch das am wenigsten reichlich vorhandene Atom in der Verbindung. Schreiben Sie zuerst den Namen dieses Atoms. - Zum Beispiel in der Molekülformel CF4, Carbon (C) kommt zuerst, also schreiben wir es zuerst: "Kohlenstoff"
- Wenn Sie nur die Atome im Molekül kennen und Sie die Molekülformel nicht kennen, machen Sie sich keine Sorgen. In kovalenten Verbindungen wird das Element, das zuerst in dieser Liste steht, zuerst in der Molekularformel geschrieben:[3]
-
- B, Si, C, Sb, As, P, N, H, Te, Se, S, I, Br, Cl, O, F
-
- Beachten Sie, dass es eine Ausnahme gibt: Wenn Sauerstoff mit einem Halogen gepaart wird (Element der Periode 7 wie F, Cl usw.), kommt das Halogen zuerst, wie in Chlormonoxid, das als ClO geschrieben wird.[4]
-
 2 Schreibe das griechische Präfix für die Nummer des zweiten Atoms. Als nächstes betrachten Sie das zweite Atom im Molekül. Bestimmen Sie, wie oft es im Molekül erscheint. Dies ist die Zahl, die in der Molekularformel daneben steht. Wenn sich neben dem zweiten Atom keine Zahl befindet, erscheint sie einmal. Finde das passende griechische Präfix aus der obigen Tabelle und schreibe es als nächstes.
2 Schreibe das griechische Präfix für die Nummer des zweiten Atoms. Als nächstes betrachten Sie das zweite Atom im Molekül. Bestimmen Sie, wie oft es im Molekül erscheint. Dies ist die Zahl, die in der Molekularformel daneben steht. Wenn sich neben dem zweiten Atom keine Zahl befindet, erscheint sie einmal. Finde das passende griechische Präfix aus der obigen Tabelle und schreibe es als nächstes. - In unserem Beispielelement CF4Fluor ist das zweite Element und es erscheint vier Mal. Wir werden das griechische Präfix für vier schreiben, tetraAls nächstes, so: "Kohlenstofftetra-"
-
 3 Benenne das zweite Atom und beende es mit "-ide"." Schreiben Sie nun einfach den Namen des zweiten Atoms, als wäre es ein Anion (negativ geladenes Ion). Mit anderen Worten, kleben Sie einfach "-ide" auf das Ende. In den meisten Fällen müssen Sie einen Buchstaben oder 2 Buchstaben am Ende des Namens ablegen, aber das ist etwas natürlicher, je mehr Sie es tun. Zum Beispiel wird Sauerstoff "Oxid", Chlor wird "Chlorid" und so weiter.[5]
3 Benenne das zweite Atom und beende es mit "-ide"." Schreiben Sie nun einfach den Namen des zweiten Atoms, als wäre es ein Anion (negativ geladenes Ion). Mit anderen Worten, kleben Sie einfach "-ide" auf das Ende. In den meisten Fällen müssen Sie einen Buchstaben oder 2 Buchstaben am Ende des Namens ablegen, aber das ist etwas natürlicher, je mehr Sie es tun. Zum Beispiel wird Sauerstoff "Oxid", Chlor wird "Chlorid" und so weiter.[5] - In unserem Beispielelement CF4Fluor ist das zweite Element, also schreiben wir es am Ende. Achten Sie darauf, die Endung -ide wie folgt hinzuzufügen: Kohlenstofftetrafluorid.
- Beachten Sie, dass das griechische Präfix und das zweite Atom zusammen ein einzelnes Wort bilden. Sie werden niemals als zwei separate Wörter geschrieben.
-
 4 Fügen Sie am Anfang ein griechisches Präfix hinzu, wenn mehr als eines der ersten Atome vorhanden ist. Bestimmen Sie, wie oft das erste Atom im Molekül erscheint. Wenn Sie die molekulare Formel haben, wird dies die Zahl sein, die nach dem ersten Atom tiefgestellt ist. Wenn es keine Zahl gibt, erscheint das erste Atom einmal. Wenn das Atom tut erscheinen mehr als einmal, schreiben Sie sein griechisches Präfix am Anfang des Namens.
4 Fügen Sie am Anfang ein griechisches Präfix hinzu, wenn mehr als eines der ersten Atome vorhanden ist. Bestimmen Sie, wie oft das erste Atom im Molekül erscheint. Wenn Sie die molekulare Formel haben, wird dies die Zahl sein, die nach dem ersten Atom tiefgestellt ist. Wenn es keine Zahl gibt, erscheint das erste Atom einmal. Wenn das Atom tut erscheinen mehr als einmal, schreiben Sie sein griechisches Präfix am Anfang des Namens. - In unserem Beispielelement CF4, Kohlenstoff erscheint einmal, also müssen wir nichts tun. Wir würden am Anfang nicht "Mono" schreiben. Sie verwenden nur "Mono" für das zweite Atom - niemals das erste. Zum Beispiel würde Distickstofftetrachlorid als N geschrieben werden2F4.
-
 5 Setze alles zusammen. Herzlichen Glückwunsch - du bist fertig. Der Name Ihrer Verbindung ist in dieser Form geschrieben:
5 Setze alles zusammen. Herzlichen Glückwunsch - du bist fertig. Der Name Ihrer Verbindung ist in dieser Form geschrieben: - [Präfix (falls mehr als eins)] [Atom 1] gefolgt von [Präfix] [Atom 2 "-ide"]
- Wir kennen den Namen unserer Verbindung bereits: Kohlenstofftetrafluorid.
-
 6 Wissen, dass bestimmte Verbindungen Ausnahmen von normalen Namensregeln sind. Die obigen Regeln werden Ihnen für fast alle normalen binären kovalenten Moleküle gut tun. Einige ausgewählte Moleküle erhalten jedoch spezielle Namen, die fast immer verwendet werden, wenn sie in wissenschaftlichen Umgebungen diskutiert werden. Es gibt keine Möglichkeit, diese vorherzusagen - man muss sie nur lernen. Einige Beispiele sind:[6]
6 Wissen, dass bestimmte Verbindungen Ausnahmen von normalen Namensregeln sind. Die obigen Regeln werden Ihnen für fast alle normalen binären kovalenten Moleküle gut tun. Einige ausgewählte Moleküle erhalten jedoch spezielle Namen, die fast immer verwendet werden, wenn sie in wissenschaftlichen Umgebungen diskutiert werden. Es gibt keine Möglichkeit, diese vorherzusagen - man muss sie nur lernen. Einige Beispiele sind:[6] - H2O ist kein Dihydrogenoxid. Es ist "Wasser."
- NH3 ist nicht Stickstofftrihydrid. Es ist "Ammoniak."
- CH4 ist nicht Kohlenstofftetrahydrid. Es ist "Methan."
Methode drei von drei:
Benennung von Säuren und Oxysäuren
-
 1 Überprüfen Sie, ob die Säure einen Sauerstoff enthält. Säuren sind Verbindungen, die Protonen an chemische Reaktionen abgeben. Oft beginnen Säuren mit einem oder mehreren H-Atomen, obwohl es einige Ausnahmen gibt.[7] Der erste Schritt zur Benennung einer Säure ist einfach: Zuerst wird schnell festgestellt, ob Sauerstoff (O) darin enthalten ist.
1 Überprüfen Sie, ob die Säure einen Sauerstoff enthält. Säuren sind Verbindungen, die Protonen an chemische Reaktionen abgeben. Oft beginnen Säuren mit einem oder mehreren H-Atomen, obwohl es einige Ausnahmen gibt.[7] Der erste Schritt zur Benennung einer Säure ist einfach: Zuerst wird schnell festgestellt, ob Sauerstoff (O) darin enthalten ist. - Nehmen wir zum Beispiel an, dass wir mit der sauren HCl arbeiten. Das tut es offensichtlich nicht habe irgendeinen Sauerstoff drin.
-
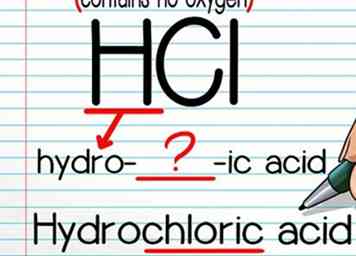 2 Verwenden Sie die Formel "Hydro- (name) -säure", wenn kein Sauerstoffatom vorhanden ist. Die Benennung von Säuren ohne Sauerstoffatom ist einfach. Schreiben Sie zuerst "hydro-", dann den Namen des Nicht-Wasserstoffatoms und dann "-ic". Normalerweise müssen Sie einen Buchstaben oder zwei Buchstaben vom Atomnamen entfernen, damit das Wort richtig "fließt" - das ist normalerweise ziemlich intuitiv. Beenden Sie mit dem Wort "Säure".
2 Verwenden Sie die Formel "Hydro- (name) -säure", wenn kein Sauerstoffatom vorhanden ist. Die Benennung von Säuren ohne Sauerstoffatom ist einfach. Schreiben Sie zuerst "hydro-", dann den Namen des Nicht-Wasserstoffatoms und dann "-ic". Normalerweise müssen Sie einen Buchstaben oder zwei Buchstaben vom Atomnamen entfernen, damit das Wort richtig "fließt" - das ist normalerweise ziemlich intuitiv. Beenden Sie mit dem Wort "Säure". - Zum Beispiel wird HCl "Salzsäure."
- Andere Beispiele umfassen HF (Fluorwasserstoffsäure) und HI (Iodwasserstoffsäure).
-
 3 Nennen Sie das Sauerstoffanion zuerst, wenn ein Sauerstoffatom vorhanden ist. Säuren, die Sauerstoff enthalten, sind ein wenig komplizierter zu nennen. Es ist in der Regel am einfachsten, zunächst das Sauerstoffanion (den Teil des Moleküls, der eine negative Ladung mit dem darin enthaltenen Sauerstoff hat) zu benennen. Normalerweise ist das der Teil, der ist nicht die Wasserstoffatome. Verwenden Sie die folgenden Schritte, um Sauerstoffanionen zu benennen:[8]
3 Nennen Sie das Sauerstoffanion zuerst, wenn ein Sauerstoffatom vorhanden ist. Säuren, die Sauerstoff enthalten, sind ein wenig komplizierter zu nennen. Es ist in der Regel am einfachsten, zunächst das Sauerstoffanion (den Teil des Moleküls, der eine negative Ladung mit dem darin enthaltenen Sauerstoff hat) zu benennen. Normalerweise ist das der Teil, der ist nicht die Wasserstoffatome. Verwenden Sie die folgenden Schritte, um Sauerstoffanionen zu benennen:[8] -
 4 Finde heraus, wie viele Anionen in derselben Serie wie deine sind. Anionen sind in der gleichen Reihe, wenn Sie Sauerstoff addieren oder subtrahieren können und die Gesamtladung die gleiche behalten, indem Sie den Oxidationszustand des Kations (der positiv geladene Teil des Anions) ändern. Ein guter Leitfaden für Oxidationsstufen ist hier verfügbar.[9]
4 Finde heraus, wie viele Anionen in derselben Serie wie deine sind. Anionen sind in der gleichen Reihe, wenn Sie Sauerstoff addieren oder subtrahieren können und die Gesamtladung die gleiche behalten, indem Sie den Oxidationszustand des Kations (der positiv geladene Teil des Anions) ändern. Ein guter Leitfaden für Oxidationsstufen ist hier verfügbar.[9] - Wenn in derselben Reihe 2 Anionen vorhanden sind, endet die 1 mit weniger Sauerstoffen mit -ite und die 1 mit mehr Sauerstoffen endet mit -ate. Zum Beispiel, SO32- und so42- sind beide möglich, abhängig davon, ob S eine Oxidationsstufe von 4+ oder 6+ aufweist. Das erste ist Sulfit und das zweite ist Sulfat basierend auf ihrer Anzahl an Sauerstoffen.
- Wenn es mehr als 2 Anionen in derselben Serie gibt, verwenden Sie das Präfix "hypo" für die 1 mit dem geringsten Sauerstoff und das Präfix "per" für die 1 mit dem meisten Sauerstoff. Zum Beispiel kann Chlor ClO bilden-, ClO2-, ClO3-und ClO4-. Diese sind benannt Hypochlorit, Chlorit, Chlorat, und Perchlorat beziehungsweise.
-
 5 Verwenden Sie den Namen des Sauerstoffanions, um den Namen der Säure zu finden. Nachdem Sie das Sauerstoffanion benannt haben, ist es nicht schwierig, den Namen der Säure selbst zu finden. Verwenden Sie die folgenden Benennungsregeln:
5 Verwenden Sie den Namen des Sauerstoffanions, um den Namen der Säure zu finden. Nachdem Sie das Sauerstoffanion benannt haben, ist es nicht schwierig, den Namen der Säure selbst zu finden. Verwenden Sie die folgenden Benennungsregeln: - Wenn das Anion in -ate endet, endet die Säure mit -ric oder -ic.
-
- Beispiel: HClO2 ist chlorige Säure (aus "Chlorat", der Name des Sauerstoffanions).
-
- Wenn das Anion in -ite endet, endet die Säure mit -ous.
-
- Beispiel: HClO3 ist Chlorsäure (aus "Chlorit", der Name des Sauerstoffanions).
-
- Fügen Sie Hypo- oder Per- format hinzu, wenn das Anion diese Präfixe hat.
-
- Beispiel: HClO4 ist perchlorige Säure (aus "Perchlorat", der Name des Sauerstoffanions).
-
- Wenn das Anion in -ate endet, endet die Säure mit -ric oder -ic.
-
 6 Identifizieren von Ausnahmen für den Säure-Namen. Wie bei normalen kovalenten Verbindungen erhalten bestimmte Säuren spezielle Namen, die nicht den normalen Benennungsregeln entsprechen. Es gibt keine einfache Möglichkeit, diese zu lernen, aber sie sind leicht zu merken, wenn man ihnen begegnet. Im Folgenden finden Sie einige Beispiele:
6 Identifizieren von Ausnahmen für den Säure-Namen. Wie bei normalen kovalenten Verbindungen erhalten bestimmte Säuren spezielle Namen, die nicht den normalen Benennungsregeln entsprechen. Es gibt keine einfache Möglichkeit, diese zu lernen, aber sie sind leicht zu merken, wenn man ihnen begegnet. Im Folgenden finden Sie einige Beispiele: - HCN ist "Blausäure" Hier gibt es keinen Sauerstoff, aber Sie erhalten immer noch den Namen des CN-Anions - nicht den Namen eines Atoms.
- CH3COOH ist "Essigsäure." Technisch wird diese Verbindung mit Benennungsregeln aus der organischen Chemie benannt, die jedoch nicht mit basischen kovalenten Verbindungen ins Spiel kommen.
Facebook
Twitter
Google+
 Minotauromaquia
Minotauromaquia
 1 Benennen Sie das erste Element in der Verbindung. Molekulare Formeln werden wie englische Wörter von links nach rechts gelesen. Im Allgemeinen ist das erste Atom (die 1 auf der linken Seite der Molekülformel) auch das am wenigsten reichlich vorhandene Atom in der Verbindung. Schreiben Sie zuerst den Namen dieses Atoms.
1 Benennen Sie das erste Element in der Verbindung. Molekulare Formeln werden wie englische Wörter von links nach rechts gelesen. Im Allgemeinen ist das erste Atom (die 1 auf der linken Seite der Molekülformel) auch das am wenigsten reichlich vorhandene Atom in der Verbindung. Schreiben Sie zuerst den Namen dieses Atoms.  2 Schreibe das griechische Präfix für die Nummer des zweiten Atoms. Als nächstes betrachten Sie das zweite Atom im Molekül. Bestimmen Sie, wie oft es im Molekül erscheint. Dies ist die Zahl, die in der Molekularformel daneben steht. Wenn sich neben dem zweiten Atom keine Zahl befindet, erscheint sie einmal. Finde das passende griechische Präfix aus der obigen Tabelle und schreibe es als nächstes.
2 Schreibe das griechische Präfix für die Nummer des zweiten Atoms. Als nächstes betrachten Sie das zweite Atom im Molekül. Bestimmen Sie, wie oft es im Molekül erscheint. Dies ist die Zahl, die in der Molekularformel daneben steht. Wenn sich neben dem zweiten Atom keine Zahl befindet, erscheint sie einmal. Finde das passende griechische Präfix aus der obigen Tabelle und schreibe es als nächstes.  3 Benenne das zweite Atom und beende es mit "-ide"." Schreiben Sie nun einfach den Namen des zweiten Atoms, als wäre es ein Anion (negativ geladenes Ion). Mit anderen Worten, kleben Sie einfach "-ide" auf das Ende. In den meisten Fällen müssen Sie einen Buchstaben oder 2 Buchstaben am Ende des Namens ablegen, aber das ist etwas natürlicher, je mehr Sie es tun. Zum Beispiel wird Sauerstoff "Oxid", Chlor wird "Chlorid" und so weiter.[5]
3 Benenne das zweite Atom und beende es mit "-ide"." Schreiben Sie nun einfach den Namen des zweiten Atoms, als wäre es ein Anion (negativ geladenes Ion). Mit anderen Worten, kleben Sie einfach "-ide" auf das Ende. In den meisten Fällen müssen Sie einen Buchstaben oder 2 Buchstaben am Ende des Namens ablegen, aber das ist etwas natürlicher, je mehr Sie es tun. Zum Beispiel wird Sauerstoff "Oxid", Chlor wird "Chlorid" und so weiter.[5]  4 Fügen Sie am Anfang ein griechisches Präfix hinzu, wenn mehr als eines der ersten Atome vorhanden ist. Bestimmen Sie, wie oft das erste Atom im Molekül erscheint. Wenn Sie die molekulare Formel haben, wird dies die Zahl sein, die nach dem ersten Atom tiefgestellt ist. Wenn es keine Zahl gibt, erscheint das erste Atom einmal. Wenn das Atom tut erscheinen mehr als einmal, schreiben Sie sein griechisches Präfix am Anfang des Namens.
4 Fügen Sie am Anfang ein griechisches Präfix hinzu, wenn mehr als eines der ersten Atome vorhanden ist. Bestimmen Sie, wie oft das erste Atom im Molekül erscheint. Wenn Sie die molekulare Formel haben, wird dies die Zahl sein, die nach dem ersten Atom tiefgestellt ist. Wenn es keine Zahl gibt, erscheint das erste Atom einmal. Wenn das Atom tut erscheinen mehr als einmal, schreiben Sie sein griechisches Präfix am Anfang des Namens.  5 Setze alles zusammen. Herzlichen Glückwunsch - du bist fertig. Der Name Ihrer Verbindung ist in dieser Form geschrieben:
5 Setze alles zusammen. Herzlichen Glückwunsch - du bist fertig. Der Name Ihrer Verbindung ist in dieser Form geschrieben:  6 Wissen, dass bestimmte Verbindungen Ausnahmen von normalen Namensregeln sind. Die obigen Regeln werden Ihnen für fast alle normalen binären kovalenten Moleküle gut tun. Einige ausgewählte Moleküle erhalten jedoch spezielle Namen, die fast immer verwendet werden, wenn sie in wissenschaftlichen Umgebungen diskutiert werden. Es gibt keine Möglichkeit, diese vorherzusagen - man muss sie nur lernen. Einige Beispiele sind:[6]
6 Wissen, dass bestimmte Verbindungen Ausnahmen von normalen Namensregeln sind. Die obigen Regeln werden Ihnen für fast alle normalen binären kovalenten Moleküle gut tun. Einige ausgewählte Moleküle erhalten jedoch spezielle Namen, die fast immer verwendet werden, wenn sie in wissenschaftlichen Umgebungen diskutiert werden. Es gibt keine Möglichkeit, diese vorherzusagen - man muss sie nur lernen. Einige Beispiele sind:[6]  1 Überprüfen Sie, ob die Säure einen Sauerstoff enthält. Säuren sind Verbindungen, die Protonen an chemische Reaktionen abgeben. Oft beginnen Säuren mit einem oder mehreren H-Atomen, obwohl es einige Ausnahmen gibt.[7] Der erste Schritt zur Benennung einer Säure ist einfach: Zuerst wird schnell festgestellt, ob Sauerstoff (O) darin enthalten ist.
1 Überprüfen Sie, ob die Säure einen Sauerstoff enthält. Säuren sind Verbindungen, die Protonen an chemische Reaktionen abgeben. Oft beginnen Säuren mit einem oder mehreren H-Atomen, obwohl es einige Ausnahmen gibt.[7] Der erste Schritt zur Benennung einer Säure ist einfach: Zuerst wird schnell festgestellt, ob Sauerstoff (O) darin enthalten ist.  2 Verwenden Sie die Formel "Hydro- (name) -säure", wenn kein Sauerstoffatom vorhanden ist. Die Benennung von Säuren ohne Sauerstoffatom ist einfach. Schreiben Sie zuerst "hydro-", dann den Namen des Nicht-Wasserstoffatoms und dann "-ic". Normalerweise müssen Sie einen Buchstaben oder zwei Buchstaben vom Atomnamen entfernen, damit das Wort richtig "fließt" - das ist normalerweise ziemlich intuitiv. Beenden Sie mit dem Wort "Säure".
2 Verwenden Sie die Formel "Hydro- (name) -säure", wenn kein Sauerstoffatom vorhanden ist. Die Benennung von Säuren ohne Sauerstoffatom ist einfach. Schreiben Sie zuerst "hydro-", dann den Namen des Nicht-Wasserstoffatoms und dann "-ic". Normalerweise müssen Sie einen Buchstaben oder zwei Buchstaben vom Atomnamen entfernen, damit das Wort richtig "fließt" - das ist normalerweise ziemlich intuitiv. Beenden Sie mit dem Wort "Säure".  3 Nennen Sie das Sauerstoffanion zuerst, wenn ein Sauerstoffatom vorhanden ist. Säuren, die Sauerstoff enthalten, sind ein wenig komplizierter zu nennen. Es ist in der Regel am einfachsten, zunächst das Sauerstoffanion (den Teil des Moleküls, der eine negative Ladung mit dem darin enthaltenen Sauerstoff hat) zu benennen. Normalerweise ist das der Teil, der ist nicht die Wasserstoffatome. Verwenden Sie die folgenden Schritte, um Sauerstoffanionen zu benennen:[8]
3 Nennen Sie das Sauerstoffanion zuerst, wenn ein Sauerstoffatom vorhanden ist. Säuren, die Sauerstoff enthalten, sind ein wenig komplizierter zu nennen. Es ist in der Regel am einfachsten, zunächst das Sauerstoffanion (den Teil des Moleküls, der eine negative Ladung mit dem darin enthaltenen Sauerstoff hat) zu benennen. Normalerweise ist das der Teil, der ist nicht die Wasserstoffatome. Verwenden Sie die folgenden Schritte, um Sauerstoffanionen zu benennen:[8]  4 Finde heraus, wie viele Anionen in derselben Serie wie deine sind. Anionen sind in der gleichen Reihe, wenn Sie Sauerstoff addieren oder subtrahieren können und die Gesamtladung die gleiche behalten, indem Sie den Oxidationszustand des Kations (der positiv geladene Teil des Anions) ändern. Ein guter Leitfaden für Oxidationsstufen ist hier verfügbar.[9]
4 Finde heraus, wie viele Anionen in derselben Serie wie deine sind. Anionen sind in der gleichen Reihe, wenn Sie Sauerstoff addieren oder subtrahieren können und die Gesamtladung die gleiche behalten, indem Sie den Oxidationszustand des Kations (der positiv geladene Teil des Anions) ändern. Ein guter Leitfaden für Oxidationsstufen ist hier verfügbar.[9]  5 Verwenden Sie den Namen des Sauerstoffanions, um den Namen der Säure zu finden. Nachdem Sie das Sauerstoffanion benannt haben, ist es nicht schwierig, den Namen der Säure selbst zu finden. Verwenden Sie die folgenden Benennungsregeln:
5 Verwenden Sie den Namen des Sauerstoffanions, um den Namen der Säure zu finden. Nachdem Sie das Sauerstoffanion benannt haben, ist es nicht schwierig, den Namen der Säure selbst zu finden. Verwenden Sie die folgenden Benennungsregeln:  6 Identifizieren von Ausnahmen für den Säure-Namen. Wie bei normalen kovalenten Verbindungen erhalten bestimmte Säuren spezielle Namen, die nicht den normalen Benennungsregeln entsprechen. Es gibt keine einfache Möglichkeit, diese zu lernen, aber sie sind leicht zu merken, wenn man ihnen begegnet. Im Folgenden finden Sie einige Beispiele:
6 Identifizieren von Ausnahmen für den Säure-Namen. Wie bei normalen kovalenten Verbindungen erhalten bestimmte Säuren spezielle Namen, die nicht den normalen Benennungsregeln entsprechen. Es gibt keine einfache Möglichkeit, diese zu lernen, aber sie sind leicht zu merken, wenn man ihnen begegnet. Im Folgenden finden Sie einige Beispiele: