Sie haben wahrscheinlich irgendwo auf dem Weg gelernt, dass Wasser aus Sauerstoff und Wasserstoff besteht. Anstatt jemandem das Wort dafür zu geben, können Sie dies selbst beweisen, indem Sie das Wasser in seine Bestandteile zurücktrennen. Die gebräuchlichste Technik zum Trennen von Wassermolekülen ist als Elektrolyse bekannt. Obwohl die Elektrolyse mit Haushaltsgeräten durchgeführt werden kann, fördert Essigsäure (Essig) die Elektrolyse nicht genug, um eine merkliche Gasmenge zu erzeugen. Das können Sie selbst beweisen, indem Sie mit Essig und dann mit Backpulver Elektrolyse machen. Sie werden feststellen, dass die Elektrolyse mit Backsoda viel mehr Gas produziert als mit Essig.
Methode eins von dreien:
Aufbau der Apparatur
-
 1 Beginnen Sie mit einer leeren Wanne. Sie können eine Plastik- oder Glaswanne benutzen. Vermeiden Sie die Verwendung einer Metallwanne, da Sie einen elektrischen Strom durch das Wasser leiten. Die Größe der Wanne spielt keine Rolle, aber ein guter Ausgangspunkt wäre die Verwendung eines 1⁄2 Gallone (1,9 L) Behälter.[1]
1 Beginnen Sie mit einer leeren Wanne. Sie können eine Plastik- oder Glaswanne benutzen. Vermeiden Sie die Verwendung einer Metallwanne, da Sie einen elektrischen Strom durch das Wasser leiten. Die Größe der Wanne spielt keine Rolle, aber ein guter Ausgangspunkt wäre die Verwendung eines 1⁄2 Gallone (1,9 L) Behälter.[1] -
 2 Band Krokodilklemmen an den Boden der Wanne. Sie werden 2 Krokodilklemmen benötigen. Einer wird an Ihre positive Elektrode (die Anode) angeschlossen und der andere wird an Ihre negative Elektrode (die Kathode) angeschlossen. Kleben Sie ein Ende jedes Clips an den inneren Boden der Wanne. Achten Sie darauf, genügend Platz zu lassen, damit Sie den Clip weiterhin öffnen und schließen können.[2]
2 Band Krokodilklemmen an den Boden der Wanne. Sie werden 2 Krokodilklemmen benötigen. Einer wird an Ihre positive Elektrode (die Anode) angeschlossen und der andere wird an Ihre negative Elektrode (die Kathode) angeschlossen. Kleben Sie ein Ende jedes Clips an den inneren Boden der Wanne. Achten Sie darauf, genügend Platz zu lassen, damit Sie den Clip weiterhin öffnen und schließen können.[2] -
 3 Schließen Sie die Elektroden an. Sie benötigen 2 Elektroden aus einem nicht reaktiven Material, das die Elektrizität gut leitet. Eine optimale Wahl ist Platin, aber wenn Sie keine Platinelektroden herumliegen haben, können Sie Graphit verwenden. Rasiere das Holz von 2 Bleistiften, um 2 Graphitstäbe zu erhalten. Clip an jede Krokodilklemme in der Wanne.
3 Schließen Sie die Elektroden an. Sie benötigen 2 Elektroden aus einem nicht reaktiven Material, das die Elektrizität gut leitet. Eine optimale Wahl ist Platin, aber wenn Sie keine Platinelektroden herumliegen haben, können Sie Graphit verwenden. Rasiere das Holz von 2 Bleistiften, um 2 Graphitstäbe zu erhalten. Clip an jede Krokodilklemme in der Wanne. - Graphitstäbe bilden große Elektroden, da sie sich nicht in Wasser auflösen und Elektrizität leiten.
Methode zwei von drei:
Elektrolyse von Wasser und Essig
-
 1 Mischen Sie eine Essiglösung. Fügen Sie 5 Esslöffel (74 ml) Essig hinzu 1⁄2 Gallone (1,9 L) Wasser. Die resultierende Lösung wird leicht sauer und in der Lage sein, eine kleine Menge Elektrizität zu leiten. Gießen Sie die Lösung in die Wanne.[3]
1 Mischen Sie eine Essiglösung. Fügen Sie 5 Esslöffel (74 ml) Essig hinzu 1⁄2 Gallone (1,9 L) Wasser. Die resultierende Lösung wird leicht sauer und in der Lage sein, eine kleine Menge Elektrizität zu leiten. Gießen Sie die Lösung in die Wanne.[3] - Sie können die gesamte Lösung verwenden oder nicht. Füllen Sie einfach die Wanne die meiste Zeit.
-
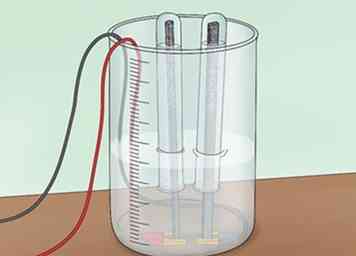 2 Invertieren Sie ein Reagenzglas über jeder Elektrode. Zuerst füllen Sie 2 Reagenzgläser mit Wasser. Sie können sie aus dem Wasserhahn oder mit dem Wasser in Ihrer Wanne füllen. Invertieren Sie jedes Reagenzglas über eine der Graphitelektroden und in das Wasser. Achten Sie darauf, keine Luftblasen in den Reagenzgläsern zu bekommen. Diese Rohre sollen jeglichen gebildeten Wasserstoff oder Sauerstoff sammeln.[4]
2 Invertieren Sie ein Reagenzglas über jeder Elektrode. Zuerst füllen Sie 2 Reagenzgläser mit Wasser. Sie können sie aus dem Wasserhahn oder mit dem Wasser in Ihrer Wanne füllen. Invertieren Sie jedes Reagenzglas über eine der Graphitelektroden und in das Wasser. Achten Sie darauf, keine Luftblasen in den Reagenzgläsern zu bekommen. Diese Rohre sollen jeglichen gebildeten Wasserstoff oder Sauerstoff sammeln.[4] - Sie müssen eine Klemme verwenden, um die Reagenzgläser über den Stäben zu halten.
-
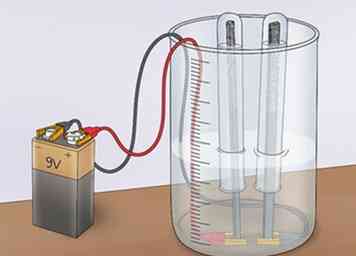 3 Verbinden Sie die Krokodilklemmen mit einem Netzteil. Schließen Sie die Krokodilklemmen (die den Elektroden gegenüberliegende Seite) an den Anschluss einer 9-V-Batterie an. Dadurch wird der Stromkreis geschlossen und Strom fließt. Der Strom wird jedoch durch die Unfähigkeit der Essiglösung, gut zu leiten, begrenzt sein. Dies bestätigt, dass Essigessigsäure die Elektrolyse von Wasser nicht fördert.[5]
3 Verbinden Sie die Krokodilklemmen mit einem Netzteil. Schließen Sie die Krokodilklemmen (die den Elektroden gegenüberliegende Seite) an den Anschluss einer 9-V-Batterie an. Dadurch wird der Stromkreis geschlossen und Strom fließt. Der Strom wird jedoch durch die Unfähigkeit der Essiglösung, gut zu leiten, begrenzt sein. Dies bestätigt, dass Essigessigsäure die Elektrolyse von Wasser nicht fördert.[5] - Diese Strombeschränkung verhindert, dass das Wasser in Wasserstoff und Sauerstoff gespalten wird.
- Essig ist eine schwache Säure, daher dissoziiert es nicht vollständig, wenn es in Wasser gelöst wird, was bedeutet, dass weniger Ionen Strom leiten.
Methode drei von drei:
Elektrolyse Wasser und Backpulver
-
 1 Füllen Sie die Wanne mit einer Natriumbicarbonatlösung. Gib 1 EL (21 g) Backpulver (Natriumbicarbonat) dazu 1⁄2 Gallone (1,9 L) Wasser. Das Backpulver löst sich in den Elektrolyten in der Lösung. Diese Elektrolyte erhöhen die Menge an Strom, die das Wasser leiten kann. [6]
1 Füllen Sie die Wanne mit einer Natriumbicarbonatlösung. Gib 1 EL (21 g) Backpulver (Natriumbicarbonat) dazu 1⁄2 Gallone (1,9 L) Wasser. Das Backpulver löst sich in den Elektrolyten in der Lösung. Diese Elektrolyte erhöhen die Menge an Strom, die das Wasser leiten kann. [6] - Backpulver bildet bei der Dissoziation Natrium- und Bicarbonationen.
-
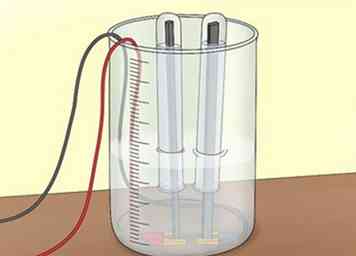 2 Bedecke die Elektroden. Füllen Sie 2 Reagenzgläser mit Wasser aus dem Wasserhahn oder aus der Wanne. Drehen Sie jedes Reagenzglas um, um jede Elektrode abzudecken. Achten Sie darauf, dass keine Luft in die Reagenzgläser gelangt. Die Rohre sammeln die Gase, die Sie während der Elektrolyse produzieren.[7]
2 Bedecke die Elektroden. Füllen Sie 2 Reagenzgläser mit Wasser aus dem Wasserhahn oder aus der Wanne. Drehen Sie jedes Reagenzglas um, um jede Elektrode abzudecken. Achten Sie darauf, dass keine Luft in die Reagenzgläser gelangt. Die Rohre sammeln die Gase, die Sie während der Elektrolyse produzieren.[7] - Verwenden Sie eine Klemme, um die Reagenzgläser über den Elektroden zu halten.
-
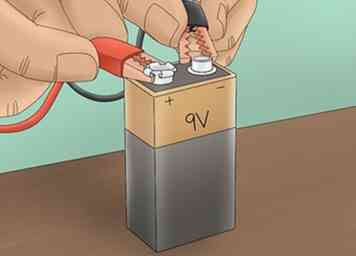 3 Schließen Sie die Stromquelle an. Schließen Sie eine Krokodilklemme an den Pluspol einer 9V-Batterie an. Verbinden Sie den anderen mit dem negativen Anschluss. Dies erzeugt eine Schaltung, die es ermöglicht, dass Strom durch die Elektrolytlösung fließt.
3 Schließen Sie die Stromquelle an. Schließen Sie eine Krokodilklemme an den Pluspol einer 9V-Batterie an. Verbinden Sie den anderen mit dem negativen Anschluss. Dies erzeugt eine Schaltung, die es ermöglicht, dass Strom durch die Elektrolytlösung fließt. -
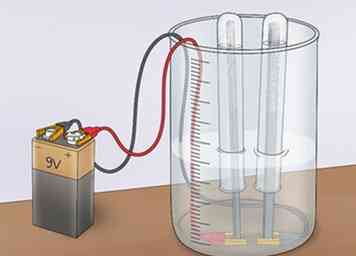 4 Beobachten Sie, wie sich Blasen an der Anode und der Kathode sammeln. Wenn der Strom durch die Lösung fließt, wird er einige der Wassermoleküle spalten. Das Ergebnis wird Wasserstoffgas sein (H2) und Sauerstoffgas (O2). Das Sauerstoffgas, das eine Ladung von -2 aufweist, wird von einer positiven Ladung angezogen und sammelt sich an der Anode (ein Elektronenakzeptor, der negative Ladungen anzieht, Anionen genannt). Das Wasserstoffgas, das eine Ladung von +1 aufweist, wird von einer negativen Ladung angezogen und sammelt sich an der Kathode (einem Elektronenakzeptor, der positive Ladungen anzieht, Kationen genannt).[8]
4 Beobachten Sie, wie sich Blasen an der Anode und der Kathode sammeln. Wenn der Strom durch die Lösung fließt, wird er einige der Wassermoleküle spalten. Das Ergebnis wird Wasserstoffgas sein (H2) und Sauerstoffgas (O2). Das Sauerstoffgas, das eine Ladung von -2 aufweist, wird von einer positiven Ladung angezogen und sammelt sich an der Anode (ein Elektronenakzeptor, der negative Ladungen anzieht, Anionen genannt). Das Wasserstoffgas, das eine Ladung von +1 aufweist, wird von einer negativen Ladung angezogen und sammelt sich an der Kathode (einem Elektronenakzeptor, der positive Ladungen anzieht, Kationen genannt).[8] - Wenn sich die Gase sammeln, werden sie um ihre jeweiligen Elektroden aus dem Wasser herausperlen und in den Reagenzgläsern eingefangen werden.
- Sie werden feststellen, dass Wasser an der Spitze des Reagenzglases verdrängt und durch die Gase ersetzt wird.
- Beachten Sie, dass das Rohr, das die Kathode bedeckt, doppelt so viel Wasser verdrängt wie das Rohr, das die Anode bedeckt. Dies liegt daran, dass doppelt so viele Wasserstoffmoleküle wie Sauerstoffmoleküle gebildet werden.
Facebook
Twitter
Google+
 Minotauromaquia
Minotauromaquia
 1 Beginnen Sie mit einer leeren Wanne. Sie können eine Plastik- oder Glaswanne benutzen. Vermeiden Sie die Verwendung einer Metallwanne, da Sie einen elektrischen Strom durch das Wasser leiten. Die Größe der Wanne spielt keine Rolle, aber ein guter Ausgangspunkt wäre die Verwendung eines
1 Beginnen Sie mit einer leeren Wanne. Sie können eine Plastik- oder Glaswanne benutzen. Vermeiden Sie die Verwendung einer Metallwanne, da Sie einen elektrischen Strom durch das Wasser leiten. Die Größe der Wanne spielt keine Rolle, aber ein guter Ausgangspunkt wäre die Verwendung eines  2 Band Krokodilklemmen an den Boden der Wanne. Sie werden 2 Krokodilklemmen benötigen. Einer wird an Ihre positive Elektrode (die Anode) angeschlossen und der andere wird an Ihre negative Elektrode (die Kathode) angeschlossen. Kleben Sie ein Ende jedes Clips an den inneren Boden der Wanne. Achten Sie darauf, genügend Platz zu lassen, damit Sie den Clip weiterhin öffnen und schließen können.[2]
2 Band Krokodilklemmen an den Boden der Wanne. Sie werden 2 Krokodilklemmen benötigen. Einer wird an Ihre positive Elektrode (die Anode) angeschlossen und der andere wird an Ihre negative Elektrode (die Kathode) angeschlossen. Kleben Sie ein Ende jedes Clips an den inneren Boden der Wanne. Achten Sie darauf, genügend Platz zu lassen, damit Sie den Clip weiterhin öffnen und schließen können.[2]  3 Schließen Sie die Elektroden an. Sie benötigen 2 Elektroden aus einem nicht reaktiven Material, das die Elektrizität gut leitet. Eine optimale Wahl ist Platin, aber wenn Sie keine Platinelektroden herumliegen haben, können Sie Graphit verwenden. Rasiere das Holz von 2 Bleistiften, um 2 Graphitstäbe zu erhalten. Clip an jede Krokodilklemme in der Wanne.
3 Schließen Sie die Elektroden an. Sie benötigen 2 Elektroden aus einem nicht reaktiven Material, das die Elektrizität gut leitet. Eine optimale Wahl ist Platin, aber wenn Sie keine Platinelektroden herumliegen haben, können Sie Graphit verwenden. Rasiere das Holz von 2 Bleistiften, um 2 Graphitstäbe zu erhalten. Clip an jede Krokodilklemme in der Wanne.  1 Mischen Sie eine Essiglösung. Fügen Sie 5 Esslöffel (74 ml) Essig hinzu
1 Mischen Sie eine Essiglösung. Fügen Sie 5 Esslöffel (74 ml) Essig hinzu  2 Invertieren Sie ein Reagenzglas über jeder Elektrode. Zuerst füllen Sie 2 Reagenzgläser mit Wasser. Sie können sie aus dem Wasserhahn oder mit dem Wasser in Ihrer Wanne füllen. Invertieren Sie jedes Reagenzglas über eine der Graphitelektroden und in das Wasser. Achten Sie darauf, keine Luftblasen in den Reagenzgläsern zu bekommen. Diese Rohre sollen jeglichen gebildeten Wasserstoff oder Sauerstoff sammeln.[4]
2 Invertieren Sie ein Reagenzglas über jeder Elektrode. Zuerst füllen Sie 2 Reagenzgläser mit Wasser. Sie können sie aus dem Wasserhahn oder mit dem Wasser in Ihrer Wanne füllen. Invertieren Sie jedes Reagenzglas über eine der Graphitelektroden und in das Wasser. Achten Sie darauf, keine Luftblasen in den Reagenzgläsern zu bekommen. Diese Rohre sollen jeglichen gebildeten Wasserstoff oder Sauerstoff sammeln.[4]  3 Verbinden Sie die Krokodilklemmen mit einem Netzteil. Schließen Sie die Krokodilklemmen (die den Elektroden gegenüberliegende Seite) an den Anschluss einer 9-V-Batterie an. Dadurch wird der Stromkreis geschlossen und Strom fließt. Der Strom wird jedoch durch die Unfähigkeit der Essiglösung, gut zu leiten, begrenzt sein. Dies bestätigt, dass Essigessigsäure die Elektrolyse von Wasser nicht fördert.[5]
3 Verbinden Sie die Krokodilklemmen mit einem Netzteil. Schließen Sie die Krokodilklemmen (die den Elektroden gegenüberliegende Seite) an den Anschluss einer 9-V-Batterie an. Dadurch wird der Stromkreis geschlossen und Strom fließt. Der Strom wird jedoch durch die Unfähigkeit der Essiglösung, gut zu leiten, begrenzt sein. Dies bestätigt, dass Essigessigsäure die Elektrolyse von Wasser nicht fördert.[5]  1 Füllen Sie die Wanne mit einer Natriumbicarbonatlösung. Gib 1 EL (21 g) Backpulver (Natriumbicarbonat) dazu
1 Füllen Sie die Wanne mit einer Natriumbicarbonatlösung. Gib 1 EL (21 g) Backpulver (Natriumbicarbonat) dazu  2 Bedecke die Elektroden. Füllen Sie 2 Reagenzgläser mit Wasser aus dem Wasserhahn oder aus der Wanne. Drehen Sie jedes Reagenzglas um, um jede Elektrode abzudecken. Achten Sie darauf, dass keine Luft in die Reagenzgläser gelangt. Die Rohre sammeln die Gase, die Sie während der Elektrolyse produzieren.[7]
2 Bedecke die Elektroden. Füllen Sie 2 Reagenzgläser mit Wasser aus dem Wasserhahn oder aus der Wanne. Drehen Sie jedes Reagenzglas um, um jede Elektrode abzudecken. Achten Sie darauf, dass keine Luft in die Reagenzgläser gelangt. Die Rohre sammeln die Gase, die Sie während der Elektrolyse produzieren.[7]  3 Schließen Sie die Stromquelle an. Schließen Sie eine Krokodilklemme an den Pluspol einer 9V-Batterie an. Verbinden Sie den anderen mit dem negativen Anschluss. Dies erzeugt eine Schaltung, die es ermöglicht, dass Strom durch die Elektrolytlösung fließt.
3 Schließen Sie die Stromquelle an. Schließen Sie eine Krokodilklemme an den Pluspol einer 9V-Batterie an. Verbinden Sie den anderen mit dem negativen Anschluss. Dies erzeugt eine Schaltung, die es ermöglicht, dass Strom durch die Elektrolytlösung fließt.  4 Beobachten Sie, wie sich Blasen an der Anode und der Kathode sammeln. Wenn der Strom durch die Lösung fließt, wird er einige der Wassermoleküle spalten. Das Ergebnis wird Wasserstoffgas sein (H2) und Sauerstoffgas (O2). Das Sauerstoffgas, das eine Ladung von -2 aufweist, wird von einer positiven Ladung angezogen und sammelt sich an der Anode (ein Elektronenakzeptor, der negative Ladungen anzieht, Anionen genannt). Das Wasserstoffgas, das eine Ladung von +1 aufweist, wird von einer negativen Ladung angezogen und sammelt sich an der Kathode (einem Elektronenakzeptor, der positive Ladungen anzieht, Kationen genannt).[8]
4 Beobachten Sie, wie sich Blasen an der Anode und der Kathode sammeln. Wenn der Strom durch die Lösung fließt, wird er einige der Wassermoleküle spalten. Das Ergebnis wird Wasserstoffgas sein (H2) und Sauerstoffgas (O2). Das Sauerstoffgas, das eine Ladung von -2 aufweist, wird von einer positiven Ladung angezogen und sammelt sich an der Anode (ein Elektronenakzeptor, der negative Ladungen anzieht, Anionen genannt). Das Wasserstoffgas, das eine Ladung von +1 aufweist, wird von einer negativen Ladung angezogen und sammelt sich an der Kathode (einem Elektronenakzeptor, der positive Ladungen anzieht, Kationen genannt).[8]