In einer chemischen Reaktion kann Materie gemäß dem Massenerhaltungsgesetz weder erzeugt noch zerstört werden, daher müssen die Produkte, die aus einer Reaktion hervorgehen, den Reaktanten entsprechen, die eine Reaktion eingehen. Dies bedeutet, dass die gleiche Menge von jedem Atom, das Sie einsetzen, wieder herauskommen muss. Stöchiometrie ist das Maß für die Elemente innerhalb einer Reaktion.[1] Es beinhaltet Berechnungen, die die Massen von Reaktanten und Produkten in einer gegebenen chemischen Reaktion berücksichtigen. Die Stöchiometrie ist eine Halbmathematik, eine Halbchemie und dreht sich um das eine einfache Prinzip - das Prinzip, dass Materie während einer Reaktion niemals verloren oder gewonnen wird. Der erste Schritt bei der Lösung eines chemischen Problems besteht darin, die Gleichung auszugleichen.
Teil eins von vier:
Ausgleich der chemischen Gleichung
-
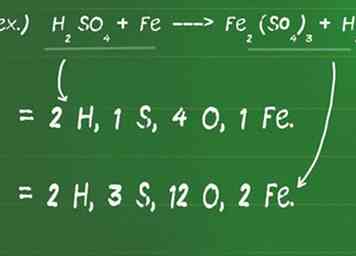 1 Notieren Sie die Anzahl der Atome, die jede Verbindung auf jeder Seite der Gleichung enthalten. Mit der chemischen Gleichung können Sie die Atome jedes Elements in der Reaktion identifizieren. Da eine chemische Reaktion niemals neue Materie erzeugen oder zerstören kann, ist eine gegebene Gleichung unsymmetrisch, wenn die Anzahl (und Arten) von Atomen auf jeder Seite der Gleichung nicht perfekt übereinstimmen.
1 Notieren Sie die Anzahl der Atome, die jede Verbindung auf jeder Seite der Gleichung enthalten. Mit der chemischen Gleichung können Sie die Atome jedes Elements in der Reaktion identifizieren. Da eine chemische Reaktion niemals neue Materie erzeugen oder zerstören kann, ist eine gegebene Gleichung unsymmetrisch, wenn die Anzahl (und Arten) von Atomen auf jeder Seite der Gleichung nicht perfekt übereinstimmen. - Vergessen Sie nicht, durch einen Koeffizienten oder Index zu multiplizieren, wenn einer vorhanden ist.
- Zum Beispiel, H2DAMIT4 + Fe ---> Fe2(DAMIT4)3 + H2
- Auf der Reaktanden - (linken) Seite der Gleichung befinden sich 2 H - Atome (H2), 1 S - Atom, 4 O - Atome (O4) und 1 Fe-Atom.
- Auf der Produktseite (rechts) der Gleichung befinden sich 2H Atome (H2), 3 S - Atome (S3), 12 O - Atome (O 12) und 2 Fe - Atome (Fe2).
-
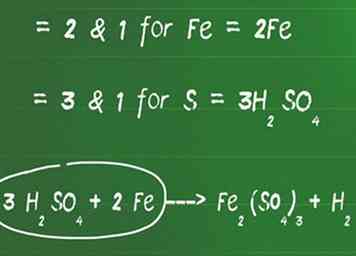 2 Fügen Sie vor Elementen, die kein Sauerstoff und Wasserstoff sind, einen Koeffizienten hinzu, um jede Seite auszugleichen. Identifizieren Sie den kleinsten gemeinsamen Faktor zwischen allen Elementen, die nicht Sauerstoff und Wasserstoff sind (Sie balancieren diese als nächstes), um die gleiche Anzahl von Atomen auf beiden Seiten zu erhalten.
2 Fügen Sie vor Elementen, die kein Sauerstoff und Wasserstoff sind, einen Koeffizienten hinzu, um jede Seite auszugleichen. Identifizieren Sie den kleinsten gemeinsamen Faktor zwischen allen Elementen, die nicht Sauerstoff und Wasserstoff sind (Sie balancieren diese als nächstes), um die gleiche Anzahl von Atomen auf beiden Seiten zu erhalten. - Zum Beispiel ist der kleinste gemeinsame Faktor zwischen 2 und 1 2 für Fe. Füge eine 2 vor dem Fe auf der linken Seite hinzu, um es auszugleichen.
- Der niedrigste gemeinsame Faktor zwischen 3 und 1 ist 3 für S. Fügen Sie eine 3 vor H hinzu2DAMIT4 um die linke und rechte Seite auszugleichen.
- In diesem Stadium sieht unsere Gleichung so aus: 3 H2DAMIT4 + 2 Fe ---> Fe2(DAMIT4)3 + H2
-
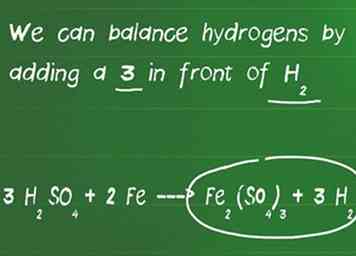 3 Gleichen Sie die Wasserstoff- und Sauerstoffatome aus. Wasserstoff- und Sauerstoffatome werden zuletzt balanciert, da sie häufig auf jeder Seite der Gleichung in mehreren Molekülen vorkommen. Zu diesem Zeitpunkt sollten Sie beim Ausgleich der Gleichung nicht vergessen, die Atome neu zu zählen, wenn Sie den Molekülen Koeffizienten hinzugefügt haben.
3 Gleichen Sie die Wasserstoff- und Sauerstoffatome aus. Wasserstoff- und Sauerstoffatome werden zuletzt balanciert, da sie häufig auf jeder Seite der Gleichung in mehreren Molekülen vorkommen. Zu diesem Zeitpunkt sollten Sie beim Ausgleich der Gleichung nicht vergessen, die Atome neu zu zählen, wenn Sie den Molekülen Koeffizienten hinzugefügt haben. - In unserem Beispiel haben wir eine 3 vor H hinzugefügt2DAMIT4 und jetzt haben Sie 6 Wasserstoffe auf der linken und nur 2 auf der rechten Seite der Gleichung. Wir haben auch 12 Sauerstoff auf der linken und 12 Sauerstoff auf der rechten Seite, also ist es ausgeglichen.
- Wir können Wasserstoffe durch Hinzufügen einer 3 vor H ausgleichen2.
- Unsere endgültige ausgeglichene Gleichung ist 3 H2DAMIT4 + 2 Fe ---> Fe2(DAMIT4)3 + 3 H2.
-
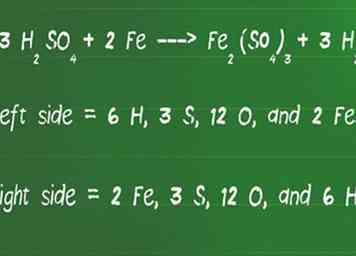 4 Zählen Sie die Anzahl der Atome auf jeder Seite der Gleichung neu, um sicherzustellen, dass sie gleich sind. Sobald Sie fertig sind, ist es klug, zurückzugehen und die Gleichung für das Gleichgewicht zu überprüfen. Dies kann durch erneutes Addieren aller Atome auf jeder Seite der Gleichung erfolgen, um sicherzustellen, dass sie auf beiden Seiten gleich sind.
4 Zählen Sie die Anzahl der Atome auf jeder Seite der Gleichung neu, um sicherzustellen, dass sie gleich sind. Sobald Sie fertig sind, ist es klug, zurückzugehen und die Gleichung für das Gleichgewicht zu überprüfen. Dies kann durch erneutes Addieren aller Atome auf jeder Seite der Gleichung erfolgen, um sicherzustellen, dass sie auf beiden Seiten gleich sind. - Lassen Sie uns unsere Gleichung überprüfen, 3 H2DAMIT4 + 2 Fe ---> Fe2(DAMIT4)3 + 3 H2für das Gleichgewicht.
- Auf der linken Seite des Pfeils befinden sich 6 H, 3 S, 12 O und 2 Fe.
- Auf der rechten Seite des Pfeils befinden sich 2 Fe, 3 S, 12 O und 6 H.
- Die linke und die rechte Seite der Gleichung stimmen überein, daher ist sie jetzt ausgeglichen.
Teil zwei von vier:
Konvertieren zwischen Gramm und Moles
-
 1 Berechnen Sie die Molmasse der Verbindung in Gramm angegeben. Die Molmasse ist die Menge in Gramm (g) eines Mols einer Verbindung.[2] Es ermöglicht Ihnen, leicht zwischen Gramm und Mol einer Substanz zu konvertieren.[3] Um die molare Masse zu berechnen, müssen Sie identifizieren, wie viele Moleküle eines Elements in der Verbindung und die Atommasse jedes Elements in der Verbindung sind.
1 Berechnen Sie die Molmasse der Verbindung in Gramm angegeben. Die Molmasse ist die Menge in Gramm (g) eines Mols einer Verbindung.[2] Es ermöglicht Ihnen, leicht zwischen Gramm und Mol einer Substanz zu konvertieren.[3] Um die molare Masse zu berechnen, müssen Sie identifizieren, wie viele Moleküle eines Elements in der Verbindung und die Atommasse jedes Elements in der Verbindung sind. - Definieren Sie die Anzahl der Atome jedes Elements in einer Verbindung. Zum Beispiel ist Glukose C6H12O6Es gibt 6 Kohlenstoffatome, 12 Wasserstoffatome und 6 Sauerstoffatome.
- Identifizieren Sie die atomare Masse in Gramm pro Mol (g / mol) jedes Atoms. Die atomaren Massen jedes Elements befinden sich normalerweise unter dem Symbol des Elements in einem Periodensystem, normalerweise als Dezimalzahl. Die atomaren Massen der Elemente in Glucose sind: Kohlenstoff, 12,0107 g / mol; Wasserstoff, 1,007 g / mol; und Sauerstoff, 15,9994 g / mol.
- Multiplizieren Sie die Atommasse jedes Elements mit der Anzahl der in der Verbindung vorhandenen Atome. Kohlenstoff: 12,0107 x 6 = 72,0642 g / mol; Wasserstoff: 1,007 x 12 = 12,084 g / mol; Sauerstoff: 15,9994 x 6 = 95,9964 g / mol.
- Die Zugabe dieser Produkte ergibt die Molmasse der Verbindung. 72,0642 + 12,084 + 95,9964 = 180,1446 g / mol. 180,14 Gramm ist die Masse von einem Mol Glucose.
-
 2 Konvertieren Gramm einer Substanz in Mole mit Molmasse. Mit der Molmasse als Umrechnungsfaktor können Sie die Anzahl der vorhandenen Mole in der angegebenen Grammzahl der Spezies berechnen. Dividiere die bekannte Menge an Gramm (g) durch die Molmasse (g / mol).[4][5] Ein einfacher Weg, um zu überprüfen, ob Sie die richtige Berechnung durchgeführt haben, besteht darin, sicherzustellen, dass sich die Einheiten aufheben und nur Molen zurücklassen.
2 Konvertieren Gramm einer Substanz in Mole mit Molmasse. Mit der Molmasse als Umrechnungsfaktor können Sie die Anzahl der vorhandenen Mole in der angegebenen Grammzahl der Spezies berechnen. Dividiere die bekannte Menge an Gramm (g) durch die Molmasse (g / mol).[4][5] Ein einfacher Weg, um zu überprüfen, ob Sie die richtige Berechnung durchgeführt haben, besteht darin, sicherzustellen, dass sich die Einheiten aufheben und nur Molen zurücklassen. - Zum Beispiel: Wie viele Mole sind in 8,2 Gramm Chlorwasserstoff (HCl) enthalten?
- Die Atommasse von H ist 1,007 und Cl ist 35,453, was die Molmasse der Verbindung 1,007 + 35,453 = 36,46 g / Mol macht.
- Teilen der Grammzahl der Substanz durch die Molmasse ergibt: 8,2 g / (36,46 g / mol) = 0,225 mol HCl.
-
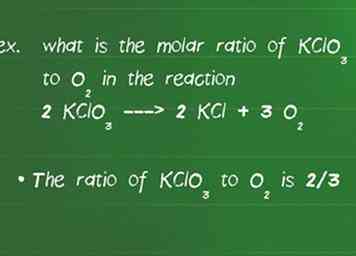 3 Bestimmen Sie das Molverhältnis zwischen den Reaktanten. Um die Ausbeute eines Produkts in einer gegebenen Reaktion zu bestimmen, müssen Sie das Molverhältnis bestimmen.Das molare Verhältnis gibt Ihnen das Verhältnis, in dem Substanzen miteinander reagieren, und ist durch den Koeffizienten der Spezies in der ausgewogenen Reaktion gegeben.[6]
3 Bestimmen Sie das Molverhältnis zwischen den Reaktanten. Um die Ausbeute eines Produkts in einer gegebenen Reaktion zu bestimmen, müssen Sie das Molverhältnis bestimmen.Das molare Verhältnis gibt Ihnen das Verhältnis, in dem Substanzen miteinander reagieren, und ist durch den Koeffizienten der Spezies in der ausgewogenen Reaktion gegeben.[6] - Zum Beispiel, was ist das Molverhältnis von KClO3 auch2 in der Reaktion 2 KClO3 ---> 2 KCl + 3 O2.
- Überprüfen Sie zunächst, ob die Gleichung ausgeglichen ist. Vergessen Sie diesen Schritt nie oder Ihre Verhältnisse werden falsch sein. In diesem Fall gibt es gleiche Mengen jedes Elements auf beiden Seiten der Reaktion, so dass es ausgeglichen ist.
- Das Verhältnis von KClO3 auch2 ist 2/3. Es ist egal, welche Zahl oben oder unten ist, solange Sie die gleichen Verbindungen oben und unten während des restlichen Problems behalten.[7]
-
 4 Kreuzmultiplizieren mit dem Molverhältnis, um Mole anderer Reaktanten zu finden. Um die Molzahl einer Spezies zu berechnen, die für eine Reaktion produziert oder benötigt wird, verwenden Sie das Molverhältnis.[8] Probleme werden Sie normalerweise auffordern, die Anzahl der benötigten Mole oder die Anzahl der Mole zu bestimmen, die in einer Reaktion bei einer bestimmten Anzahl von Gramm Reaktant erzeugt werden.
4 Kreuzmultiplizieren mit dem Molverhältnis, um Mole anderer Reaktanten zu finden. Um die Molzahl einer Spezies zu berechnen, die für eine Reaktion produziert oder benötigt wird, verwenden Sie das Molverhältnis.[8] Probleme werden Sie normalerweise auffordern, die Anzahl der benötigten Mole oder die Anzahl der Mole zu bestimmen, die in einer Reaktion bei einer bestimmten Anzahl von Gramm Reaktant erzeugt werden. - Zum Beispiel, angesichts der Reaktion N2 + 3 H2 ---> 2 NH3 wie viele Mol NH3 wird mit 3,00 Gramm N hergestellt werden2 mit ausreichend H reagieren2?
- In diesem Beispiel reicht H aus2 bedeutet, dass genug verfügbar ist und Sie es nicht berücksichtigen müssen, um das Problem zu lösen.
- Konvertieren Sie zuerst Gramm von N2 zu Maulwürfen. Die Atommasse von Stickstoff beträgt 14,0067 g / mol, also die Molmasse von N2 ist 28,0134 g / mol. Die Aufteilung der Masse nach Molmasse ergibt 3,00 g / 28,0134 g / mol = 0,107 mol.
- Richten Sie die Verhältnisse ein, die durch die Frage gegeben sind: NH3: N2 = x / 0,107 mol
- Kreuz multiplizieren Sie dieses Verhältnis mit dem Molverhältnis von NH3 zu N2: 2: 1. x / 0,107 mol = 2/1 = (2 × 0,107) = 1 × 0,214 mol.
-
 5 Überführen Mole zurück in die Masse mit der Molmasse der Spezies. Sie werden wieder Molmasse verwenden, aber dieses Mal werden Sie multiplizieren, um Mole zurück in Gramm zu konvertieren. Achten Sie darauf, die Molmasse der richtigen Spezies zu verwenden.
5 Überführen Mole zurück in die Masse mit der Molmasse der Spezies. Sie werden wieder Molmasse verwenden, aber dieses Mal werden Sie multiplizieren, um Mole zurück in Gramm zu konvertieren. Achten Sie darauf, die Molmasse der richtigen Spezies zu verwenden. - Die Molmasse von NH3 ist 17,028 g / mol. Daher sind 0,214 Mol x (17,028 Gramm / Mol) = 3,647 Gramm NH3.
Teil drei von vier:
Konvertieren zwischen Litern von Gas und Moles
-
 1 Bestimmen Sie, ob die Reaktion bei Standardtemperatur und -druck (STP) stattfindet. STP ist der Satz von Bedingungen, bei denen 1 Mol eines idealen Gases 22,414 Liter (L) Volumen einnehmen wird.[9] Die Standardtemperatur beträgt 273,15 Kelvin (K) und der Standarddruck beträgt 1 Atmosphäre (atm).[10]
1 Bestimmen Sie, ob die Reaktion bei Standardtemperatur und -druck (STP) stattfindet. STP ist der Satz von Bedingungen, bei denen 1 Mol eines idealen Gases 22,414 Liter (L) Volumen einnehmen wird.[9] Die Standardtemperatur beträgt 273,15 Kelvin (K) und der Standarddruck beträgt 1 Atmosphäre (atm).[10] - Im Allgemeinen wird eine Reaktion sagen, dass sie bei 1 atm und 273 K gegeben wird oder einfach STP sagen wird.
-
 2 Verwenden Sie den Umrechnungsfaktor 22.414 L / mol, um Liter Gas in Mol umzuwandeln. Wenn Ihre Reaktion bei STP stattfindet, können Sie 22,414 L / mol verwenden, um die Anzahl der Mole in einem gegebenen Gasvolumen zu berechnen.[11] Teilen Sie das Volumen des Gases (L) durch den Umrechnungsfaktor, um Mole zu bestimmen.
2 Verwenden Sie den Umrechnungsfaktor 22.414 L / mol, um Liter Gas in Mol umzuwandeln. Wenn Ihre Reaktion bei STP stattfindet, können Sie 22,414 L / mol verwenden, um die Anzahl der Mole in einem gegebenen Gasvolumen zu berechnen.[11] Teilen Sie das Volumen des Gases (L) durch den Umrechnungsfaktor, um Mole zu bestimmen. - Konvertieren Sie zum Beispiel 3,2 Liter N2 Gas zu Molen: 3,2 l / 22,414 l / mol = 0,143 mol.
-
 3 Verwenden Sie das ideale Gasgesetz, um Liter Gas nicht bei STP umzuwandeln. Wenn Sie eine Reaktion erhalten, die bei STP nicht auftritt, müssen Sie das ideale Gasgesetz PV = nRT verwenden, um die Anzahl der Mole in der Reaktion zu bestimmen.[12] P ist der Druck in Atmosphären, V ist das Volumen in Litern, n ist die Anzahl der Mole, R ist die Gasgesetzkonstante 0,0821 L-atm / Mol-Grad und T ist die Temperatur in Grad Kelvin.[13]
3 Verwenden Sie das ideale Gasgesetz, um Liter Gas nicht bei STP umzuwandeln. Wenn Sie eine Reaktion erhalten, die bei STP nicht auftritt, müssen Sie das ideale Gasgesetz PV = nRT verwenden, um die Anzahl der Mole in der Reaktion zu bestimmen.[12] P ist der Druck in Atmosphären, V ist das Volumen in Litern, n ist die Anzahl der Mole, R ist die Gasgesetzkonstante 0,0821 L-atm / Mol-Grad und T ist die Temperatur in Grad Kelvin.[13] - Die Gleichung kann neu angeordnet werden, um nach Molen zu unterscheiden: n = RT / PV.
- Die Einheiten der Gaskonstanten sind so ausgelegt, dass sie die Einheiten der anderen Variablen löschen.
- Bestimmen Sie zum Beispiel die Anzahl der Mole in 2,4 Liter O2 bei 300 K und 1,5 atm. Das Einstecken der Variablen ergibt: n = (0,0821 x 300) / (1,5 x 2) = 24,63 / 3,6 = 6,842 Mol O2
Teil vier von vier:
Konvertieren zwischen Litern von Flüssigkeit und Moles
-
 1 Berechnen Sie die Dichte der Flüssigkeit. Manchmal geben chemische Gleichungen Ihnen das Volumen eines flüssigen Reaktanten und benötigen die Menge an Gramm oder Mol, die für die Reaktion benötigt werden. Um in Gramm zu konvertieren, verwenden Sie die Dichte dieser Flüssigkeit. Die Dichte ist durch Masse / Volumen gegeben.[14]
1 Berechnen Sie die Dichte der Flüssigkeit. Manchmal geben chemische Gleichungen Ihnen das Volumen eines flüssigen Reaktanten und benötigen die Menge an Gramm oder Mol, die für die Reaktion benötigt werden. Um in Gramm zu konvertieren, verwenden Sie die Dichte dieser Flüssigkeit. Die Dichte ist durch Masse / Volumen gegeben.[14] - Wenn die Dichte nicht innerhalb des Problems angegeben ist, müssen Sie möglicherweise in einem Referenztext oder online nachschlagen.
-
 2 Konvertieren Sie das Volumen in Milliliter (ml). Um das Volumen der Flüssigkeit in Masse (g) umzuwandeln, müssen Sie die Dichte dieser Flüssigkeit verwenden. Die Dichte wird in Gramm pro Milliliter (g / ml) angegeben, daher muss das Volumen der Flüssigkeit in Milliliter zur Umwandlung angegeben werden.
2 Konvertieren Sie das Volumen in Milliliter (ml). Um das Volumen der Flüssigkeit in Masse (g) umzuwandeln, müssen Sie die Dichte dieser Flüssigkeit verwenden. Die Dichte wird in Gramm pro Milliliter (g / ml) angegeben, daher muss das Volumen der Flüssigkeit in Milliliter zur Umwandlung angegeben werden. - Identifizieren Sie das angegebene Volumen. Angenommen, das Problem besagt, dass Sie 1 Liter H haben2O. Zum Umrechnen in ml multiplizieren Sie einfach mit 1000. Es gibt 1000 Milliliter in einem Liter Wasser.
-
 3 Multiplizieren Sie die Lautstärke mit der Dichte. Wenn Sie ein Volumen (ml) mit der Dichte dieser Flüssigkeit (g / ml) multiplizieren, heben sich die Milliliter auf und Sie bleiben mit Gramm der Substanz zurück.[15]
3 Multiplizieren Sie die Lautstärke mit der Dichte. Wenn Sie ein Volumen (ml) mit der Dichte dieser Flüssigkeit (g / ml) multiplizieren, heben sich die Milliliter auf und Sie bleiben mit Gramm der Substanz zurück.[15] - Die Dichte von H2O ist beispielsweise ungefähr 1,0 g / ml.[16]
-
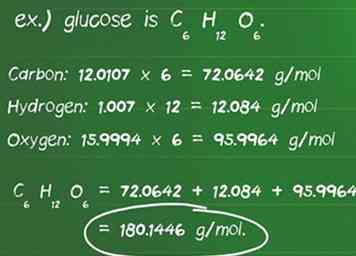 4 Berechnen Sie die Molmasse des Reaktanten. Die Molmasse ist die Menge in Gramm (g) eines Mols einer Verbindung. Es ermöglicht Ihnen, leicht zwischen Gramm und Mol einer Substanz zu konvertieren. Um die molare Masse zu berechnen, müssen Sie identifizieren, wie viele Moleküle eines Elements in einer Verbindung und die Atommasse jedes Elements in der Verbindung sind.
4 Berechnen Sie die Molmasse des Reaktanten. Die Molmasse ist die Menge in Gramm (g) eines Mols einer Verbindung. Es ermöglicht Ihnen, leicht zwischen Gramm und Mol einer Substanz zu konvertieren. Um die molare Masse zu berechnen, müssen Sie identifizieren, wie viele Moleküle eines Elements in einer Verbindung und die Atommasse jedes Elements in der Verbindung sind. - Definieren Sie die Anzahl der Atome jedes Elements in einer Verbindung. Zum Beispiel ist Glukose C6H12O6Es gibt 6 Kohlenstoffatome, 12 Wasserstoffatome und 6 Sauerstoffatome.
- Identifizieren Sie die atomare Masse in Gramm pro Mol (g / mol) jedes Atoms. Die atomaren Massen der Elemente in Glucose sind: Kohlenstoff, 12,0107 g / mol; Wasserstoff, 1,007 g / mol; und Sauerstoff, 15,9994 g / mol.
- Multiplizieren Sie die Atommasse jedes Elements mit der Anzahl der in der Verbindung vorhandenen Atome.Kohlenstoff: 12,0107 x 6 = 72,0642 g / mol; Wasserstoff: 1,007 x 12 = 12,084 g / mol; Sauerstoff: 15,9994 x 6 = 95,9964 g / mol.
- Die Zugabe dieser Produkte ergibt die Molmasse der Verbindung. 72,0642 + 12,084 + 95,9964 = 180,1446 g / mol. 180,14 Gramm ist die Masse von einem Mol Glucose.
-
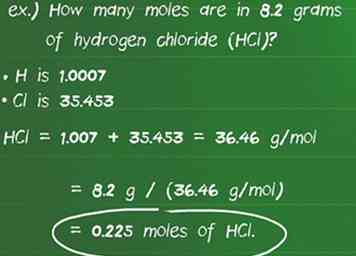 5 Konvertieren Gramm einer Substanz in Mole mit Molmasse. Mit der Molmasse als Umrechnungsfaktor können Sie die Anzahl der vorhandenen Mole in der angegebenen Grammzahl der Spezies berechnen. Dividiere die bekannte Menge an Gramm (g) durch die Molmasse (g / mol).[17][18] Ein einfacher Weg, um zu überprüfen, ob Sie die richtige Berechnung durchgeführt haben, besteht darin, sicherzustellen, dass sich die Einheiten aufheben und nur Molen zurücklassen.
5 Konvertieren Gramm einer Substanz in Mole mit Molmasse. Mit der Molmasse als Umrechnungsfaktor können Sie die Anzahl der vorhandenen Mole in der angegebenen Grammzahl der Spezies berechnen. Dividiere die bekannte Menge an Gramm (g) durch die Molmasse (g / mol).[17][18] Ein einfacher Weg, um zu überprüfen, ob Sie die richtige Berechnung durchgeführt haben, besteht darin, sicherzustellen, dass sich die Einheiten aufheben und nur Molen zurücklassen. - Zum Beispiel: Wie viele Mole sind in 8,2 Gramm Chlorwasserstoff (HCl) enthalten?
- Die Atommasse von H ist 1,007 und Cl ist 35,453, was die Molmasse der Verbindung 1,007 + 35,453 = 36,46 g / Mol macht.
- Teilen der Grammzahl der Substanz durch die Molmasse ergibt: 8,2 g / (36,46 g / mol) = 0,225 mol HCl.
 Minotauromaquia
Minotauromaquia
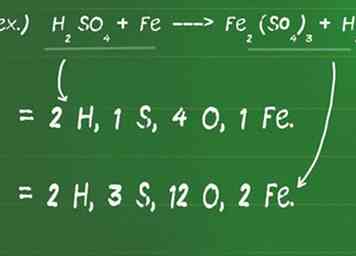 1 Notieren Sie die Anzahl der Atome, die jede Verbindung auf jeder Seite der Gleichung enthalten. Mit der chemischen Gleichung können Sie die Atome jedes Elements in der Reaktion identifizieren. Da eine chemische Reaktion niemals neue Materie erzeugen oder zerstören kann, ist eine gegebene Gleichung unsymmetrisch, wenn die Anzahl (und Arten) von Atomen auf jeder Seite der Gleichung nicht perfekt übereinstimmen.
1 Notieren Sie die Anzahl der Atome, die jede Verbindung auf jeder Seite der Gleichung enthalten. Mit der chemischen Gleichung können Sie die Atome jedes Elements in der Reaktion identifizieren. Da eine chemische Reaktion niemals neue Materie erzeugen oder zerstören kann, ist eine gegebene Gleichung unsymmetrisch, wenn die Anzahl (und Arten) von Atomen auf jeder Seite der Gleichung nicht perfekt übereinstimmen. 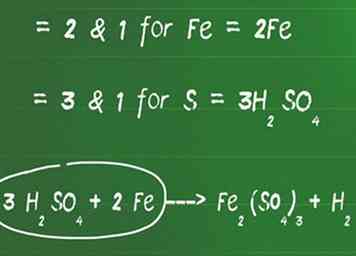 2 Fügen Sie vor Elementen, die kein Sauerstoff und Wasserstoff sind, einen Koeffizienten hinzu, um jede Seite auszugleichen. Identifizieren Sie den kleinsten gemeinsamen Faktor zwischen allen Elementen, die nicht Sauerstoff und Wasserstoff sind (Sie balancieren diese als nächstes), um die gleiche Anzahl von Atomen auf beiden Seiten zu erhalten.
2 Fügen Sie vor Elementen, die kein Sauerstoff und Wasserstoff sind, einen Koeffizienten hinzu, um jede Seite auszugleichen. Identifizieren Sie den kleinsten gemeinsamen Faktor zwischen allen Elementen, die nicht Sauerstoff und Wasserstoff sind (Sie balancieren diese als nächstes), um die gleiche Anzahl von Atomen auf beiden Seiten zu erhalten. 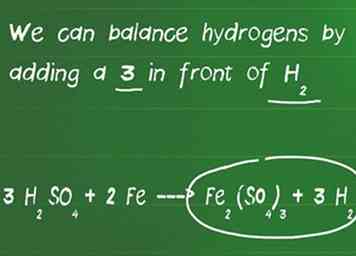 3 Gleichen Sie die Wasserstoff- und Sauerstoffatome aus. Wasserstoff- und Sauerstoffatome werden zuletzt balanciert, da sie häufig auf jeder Seite der Gleichung in mehreren Molekülen vorkommen. Zu diesem Zeitpunkt sollten Sie beim Ausgleich der Gleichung nicht vergessen, die Atome neu zu zählen, wenn Sie den Molekülen Koeffizienten hinzugefügt haben.
3 Gleichen Sie die Wasserstoff- und Sauerstoffatome aus. Wasserstoff- und Sauerstoffatome werden zuletzt balanciert, da sie häufig auf jeder Seite der Gleichung in mehreren Molekülen vorkommen. Zu diesem Zeitpunkt sollten Sie beim Ausgleich der Gleichung nicht vergessen, die Atome neu zu zählen, wenn Sie den Molekülen Koeffizienten hinzugefügt haben. 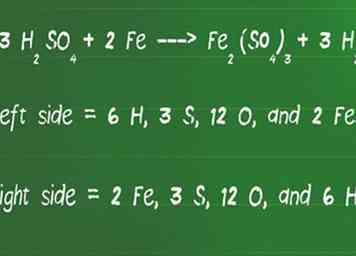 4 Zählen Sie die Anzahl der Atome auf jeder Seite der Gleichung neu, um sicherzustellen, dass sie gleich sind. Sobald Sie fertig sind, ist es klug, zurückzugehen und die Gleichung für das Gleichgewicht zu überprüfen. Dies kann durch erneutes Addieren aller Atome auf jeder Seite der Gleichung erfolgen, um sicherzustellen, dass sie auf beiden Seiten gleich sind.
4 Zählen Sie die Anzahl der Atome auf jeder Seite der Gleichung neu, um sicherzustellen, dass sie gleich sind. Sobald Sie fertig sind, ist es klug, zurückzugehen und die Gleichung für das Gleichgewicht zu überprüfen. Dies kann durch erneutes Addieren aller Atome auf jeder Seite der Gleichung erfolgen, um sicherzustellen, dass sie auf beiden Seiten gleich sind.  1 Berechnen Sie die Molmasse der Verbindung in Gramm angegeben. Die Molmasse ist die Menge in Gramm (g) eines Mols einer Verbindung.[2] Es ermöglicht Ihnen, leicht zwischen Gramm und Mol einer Substanz zu konvertieren.[3] Um die molare Masse zu berechnen, müssen Sie identifizieren, wie viele Moleküle eines Elements in der Verbindung und die Atommasse jedes Elements in der Verbindung sind.
1 Berechnen Sie die Molmasse der Verbindung in Gramm angegeben. Die Molmasse ist die Menge in Gramm (g) eines Mols einer Verbindung.[2] Es ermöglicht Ihnen, leicht zwischen Gramm und Mol einer Substanz zu konvertieren.[3] Um die molare Masse zu berechnen, müssen Sie identifizieren, wie viele Moleküle eines Elements in der Verbindung und die Atommasse jedes Elements in der Verbindung sind.  2 Konvertieren Gramm einer Substanz in Mole mit Molmasse. Mit der Molmasse als Umrechnungsfaktor können Sie die Anzahl der vorhandenen Mole in der angegebenen Grammzahl der Spezies berechnen. Dividiere die bekannte Menge an Gramm (g) durch die Molmasse (g / mol).[4][5] Ein einfacher Weg, um zu überprüfen, ob Sie die richtige Berechnung durchgeführt haben, besteht darin, sicherzustellen, dass sich die Einheiten aufheben und nur Molen zurücklassen.
2 Konvertieren Gramm einer Substanz in Mole mit Molmasse. Mit der Molmasse als Umrechnungsfaktor können Sie die Anzahl der vorhandenen Mole in der angegebenen Grammzahl der Spezies berechnen. Dividiere die bekannte Menge an Gramm (g) durch die Molmasse (g / mol).[4][5] Ein einfacher Weg, um zu überprüfen, ob Sie die richtige Berechnung durchgeführt haben, besteht darin, sicherzustellen, dass sich die Einheiten aufheben und nur Molen zurücklassen. 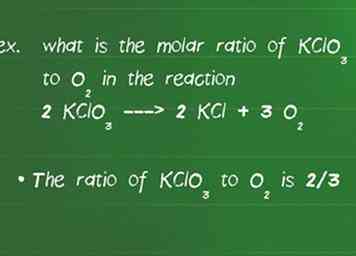 3 Bestimmen Sie das Molverhältnis zwischen den Reaktanten. Um die Ausbeute eines Produkts in einer gegebenen Reaktion zu bestimmen, müssen Sie das Molverhältnis bestimmen.Das molare Verhältnis gibt Ihnen das Verhältnis, in dem Substanzen miteinander reagieren, und ist durch den Koeffizienten der Spezies in der ausgewogenen Reaktion gegeben.[6]
3 Bestimmen Sie das Molverhältnis zwischen den Reaktanten. Um die Ausbeute eines Produkts in einer gegebenen Reaktion zu bestimmen, müssen Sie das Molverhältnis bestimmen.Das molare Verhältnis gibt Ihnen das Verhältnis, in dem Substanzen miteinander reagieren, und ist durch den Koeffizienten der Spezies in der ausgewogenen Reaktion gegeben.[6]  4 Kreuzmultiplizieren mit dem Molverhältnis, um Mole anderer Reaktanten zu finden. Um die Molzahl einer Spezies zu berechnen, die für eine Reaktion produziert oder benötigt wird, verwenden Sie das Molverhältnis.[8] Probleme werden Sie normalerweise auffordern, die Anzahl der benötigten Mole oder die Anzahl der Mole zu bestimmen, die in einer Reaktion bei einer bestimmten Anzahl von Gramm Reaktant erzeugt werden.
4 Kreuzmultiplizieren mit dem Molverhältnis, um Mole anderer Reaktanten zu finden. Um die Molzahl einer Spezies zu berechnen, die für eine Reaktion produziert oder benötigt wird, verwenden Sie das Molverhältnis.[8] Probleme werden Sie normalerweise auffordern, die Anzahl der benötigten Mole oder die Anzahl der Mole zu bestimmen, die in einer Reaktion bei einer bestimmten Anzahl von Gramm Reaktant erzeugt werden.  5 Überführen Mole zurück in die Masse mit der Molmasse der Spezies. Sie werden wieder Molmasse verwenden, aber dieses Mal werden Sie multiplizieren, um Mole zurück in Gramm zu konvertieren. Achten Sie darauf, die Molmasse der richtigen Spezies zu verwenden.
5 Überführen Mole zurück in die Masse mit der Molmasse der Spezies. Sie werden wieder Molmasse verwenden, aber dieses Mal werden Sie multiplizieren, um Mole zurück in Gramm zu konvertieren. Achten Sie darauf, die Molmasse der richtigen Spezies zu verwenden.  1 Bestimmen Sie, ob die Reaktion bei Standardtemperatur und -druck (STP) stattfindet. STP ist der Satz von Bedingungen, bei denen 1 Mol eines idealen Gases 22,414 Liter (L) Volumen einnehmen wird.[9] Die Standardtemperatur beträgt 273,15 Kelvin (K) und der Standarddruck beträgt 1 Atmosphäre (atm).[10]
1 Bestimmen Sie, ob die Reaktion bei Standardtemperatur und -druck (STP) stattfindet. STP ist der Satz von Bedingungen, bei denen 1 Mol eines idealen Gases 22,414 Liter (L) Volumen einnehmen wird.[9] Die Standardtemperatur beträgt 273,15 Kelvin (K) und der Standarddruck beträgt 1 Atmosphäre (atm).[10]  2 Verwenden Sie den Umrechnungsfaktor 22.414 L / mol, um Liter Gas in Mol umzuwandeln. Wenn Ihre Reaktion bei STP stattfindet, können Sie 22,414 L / mol verwenden, um die Anzahl der Mole in einem gegebenen Gasvolumen zu berechnen.[11] Teilen Sie das Volumen des Gases (L) durch den Umrechnungsfaktor, um Mole zu bestimmen.
2 Verwenden Sie den Umrechnungsfaktor 22.414 L / mol, um Liter Gas in Mol umzuwandeln. Wenn Ihre Reaktion bei STP stattfindet, können Sie 22,414 L / mol verwenden, um die Anzahl der Mole in einem gegebenen Gasvolumen zu berechnen.[11] Teilen Sie das Volumen des Gases (L) durch den Umrechnungsfaktor, um Mole zu bestimmen.  3 Verwenden Sie das ideale Gasgesetz, um Liter Gas nicht bei STP umzuwandeln. Wenn Sie eine Reaktion erhalten, die bei STP nicht auftritt, müssen Sie das ideale Gasgesetz PV = nRT verwenden, um die Anzahl der Mole in der Reaktion zu bestimmen.[12] P ist der Druck in Atmosphären, V ist das Volumen in Litern, n ist die Anzahl der Mole, R ist die Gasgesetzkonstante 0,0821 L-atm / Mol-Grad und T ist die Temperatur in Grad Kelvin.[13]
3 Verwenden Sie das ideale Gasgesetz, um Liter Gas nicht bei STP umzuwandeln. Wenn Sie eine Reaktion erhalten, die bei STP nicht auftritt, müssen Sie das ideale Gasgesetz PV = nRT verwenden, um die Anzahl der Mole in der Reaktion zu bestimmen.[12] P ist der Druck in Atmosphären, V ist das Volumen in Litern, n ist die Anzahl der Mole, R ist die Gasgesetzkonstante 0,0821 L-atm / Mol-Grad und T ist die Temperatur in Grad Kelvin.[13]  1 Berechnen Sie die Dichte der Flüssigkeit. Manchmal geben chemische Gleichungen Ihnen das Volumen eines flüssigen Reaktanten und benötigen die Menge an Gramm oder Mol, die für die Reaktion benötigt werden. Um in Gramm zu konvertieren, verwenden Sie die Dichte dieser Flüssigkeit. Die Dichte ist durch Masse / Volumen gegeben.[14]
1 Berechnen Sie die Dichte der Flüssigkeit. Manchmal geben chemische Gleichungen Ihnen das Volumen eines flüssigen Reaktanten und benötigen die Menge an Gramm oder Mol, die für die Reaktion benötigt werden. Um in Gramm zu konvertieren, verwenden Sie die Dichte dieser Flüssigkeit. Die Dichte ist durch Masse / Volumen gegeben.[14]  2 Konvertieren Sie das Volumen in Milliliter (ml). Um das Volumen der Flüssigkeit in Masse (g) umzuwandeln, müssen Sie die Dichte dieser Flüssigkeit verwenden. Die Dichte wird in Gramm pro Milliliter (g / ml) angegeben, daher muss das Volumen der Flüssigkeit in Milliliter zur Umwandlung angegeben werden.
2 Konvertieren Sie das Volumen in Milliliter (ml). Um das Volumen der Flüssigkeit in Masse (g) umzuwandeln, müssen Sie die Dichte dieser Flüssigkeit verwenden. Die Dichte wird in Gramm pro Milliliter (g / ml) angegeben, daher muss das Volumen der Flüssigkeit in Milliliter zur Umwandlung angegeben werden.  3 Multiplizieren Sie die Lautstärke mit der Dichte. Wenn Sie ein Volumen (ml) mit der Dichte dieser Flüssigkeit (g / ml) multiplizieren, heben sich die Milliliter auf und Sie bleiben mit Gramm der Substanz zurück.[15]
3 Multiplizieren Sie die Lautstärke mit der Dichte. Wenn Sie ein Volumen (ml) mit der Dichte dieser Flüssigkeit (g / ml) multiplizieren, heben sich die Milliliter auf und Sie bleiben mit Gramm der Substanz zurück.[15] 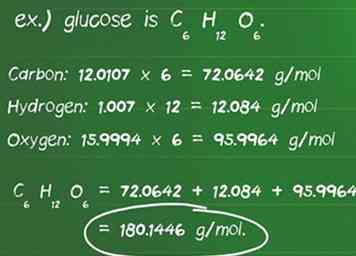 4 Berechnen Sie die Molmasse des Reaktanten. Die Molmasse ist die Menge in Gramm (g) eines Mols einer Verbindung. Es ermöglicht Ihnen, leicht zwischen Gramm und Mol einer Substanz zu konvertieren. Um die molare Masse zu berechnen, müssen Sie identifizieren, wie viele Moleküle eines Elements in einer Verbindung und die Atommasse jedes Elements in der Verbindung sind.
4 Berechnen Sie die Molmasse des Reaktanten. Die Molmasse ist die Menge in Gramm (g) eines Mols einer Verbindung. Es ermöglicht Ihnen, leicht zwischen Gramm und Mol einer Substanz zu konvertieren. Um die molare Masse zu berechnen, müssen Sie identifizieren, wie viele Moleküle eines Elements in einer Verbindung und die Atommasse jedes Elements in der Verbindung sind. 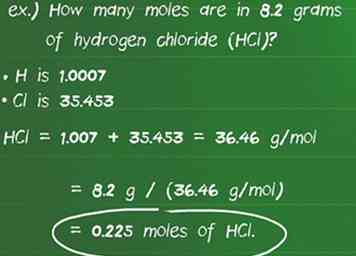 5 Konvertieren Gramm einer Substanz in Mole mit Molmasse. Mit der Molmasse als Umrechnungsfaktor können Sie die Anzahl der vorhandenen Mole in der angegebenen Grammzahl der Spezies berechnen. Dividiere die bekannte Menge an Gramm (g) durch die Molmasse (g / mol).[17][18] Ein einfacher Weg, um zu überprüfen, ob Sie die richtige Berechnung durchgeführt haben, besteht darin, sicherzustellen, dass sich die Einheiten aufheben und nur Molen zurücklassen.
5 Konvertieren Gramm einer Substanz in Mole mit Molmasse. Mit der Molmasse als Umrechnungsfaktor können Sie die Anzahl der vorhandenen Mole in der angegebenen Grammzahl der Spezies berechnen. Dividiere die bekannte Menge an Gramm (g) durch die Molmasse (g / mol).[17][18] Ein einfacher Weg, um zu überprüfen, ob Sie die richtige Berechnung durchgeführt haben, besteht darin, sicherzustellen, dass sich die Einheiten aufheben und nur Molen zurücklassen.