Die Ordnungszahl eines Elements ist die Anzahl der Protonen im Kern eines einzelnen Atoms dieses Elements. Die Ordnungszahl eines Elements oder Isotops kann sich nicht ändern, daher können Sie die Ordnungszahl verwenden, um andere Eigenschaften wie die Anzahl der Elektronen und Neutronen in einem Atom zu bestimmen.
Teil eins von zwei:
Die Atomzahl finden
-
 1 Suchen Sie eine Kopie des Periodensystems. Wir haben hier einen, wenn Sie keinen haben. Jedes einzelne Element hat eine andere Ordnungszahl, und die Elemente sind nach ihren Ordnungszahlen geordnet. Entweder man findet eine Kopie des Periodensystems oder man merkt sich eine.
1 Suchen Sie eine Kopie des Periodensystems. Wir haben hier einen, wenn Sie keinen haben. Jedes einzelne Element hat eine andere Ordnungszahl, und die Elemente sind nach ihren Ordnungszahlen geordnet. Entweder man findet eine Kopie des Periodensystems oder man merkt sich eine. - Die meisten Chemie-Lehrbücher haben ein Periodensystem auf der Innenseite gedruckt.
-
 2 Finde das Element, das du studierst. Die meisten Periodentabellen enthalten den vollständigen Namen der Elemente sowie das chemische Symbol (z. B. Hg für Mercury). Wenn Sie Probleme haben, es zu finden, suchen Sie online nach "chemischen Symbol", gefolgt von dem Namen des Elements.
2 Finde das Element, das du studierst. Die meisten Periodentabellen enthalten den vollständigen Namen der Elemente sowie das chemische Symbol (z. B. Hg für Mercury). Wenn Sie Probleme haben, es zu finden, suchen Sie online nach "chemischen Symbol", gefolgt von dem Namen des Elements. -
 3 Suchen Sie nach der Ordnungszahl. Die Ordnungszahl befindet sich normalerweise in der oberen linken oder oberen rechten Ecke der Element-Box, aber sie könnte sich an einer anderen Stelle befinden. Dies ist immer eine ganze Zahl.
3 Suchen Sie nach der Ordnungszahl. Die Ordnungszahl befindet sich normalerweise in der oberen linken oder oberen rechten Ecke der Element-Box, aber sie könnte sich an einer anderen Stelle befinden. Dies ist immer eine ganze Zahl. - Wenn die Zahl einen Dezimalpunkt enthält, betrachten Sie wahrscheinlich stattdessen die atomare Masse.
-
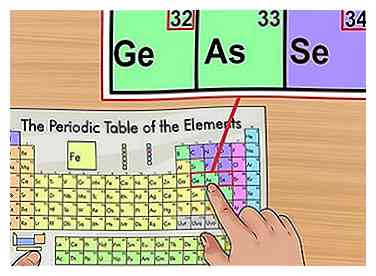 4 Bestätigen Sie anhand von Elementen in der Nähe. Das Periodensystem ist in der Reihenfolge der Ordnungszahl angeordnet. Wenn die Ordnungszahl Ihres Elements "33" ist, sollte das Element auf der linken Seite "32" und das Element auf der rechten Seite eine "34" haben. Wenn dieses Muster zutrifft, haben Sie definitiv die Ordnungszahl gefunden.
4 Bestätigen Sie anhand von Elementen in der Nähe. Das Periodensystem ist in der Reihenfolge der Ordnungszahl angeordnet. Wenn die Ordnungszahl Ihres Elements "33" ist, sollte das Element auf der linken Seite "32" und das Element auf der rechten Seite eine "34" haben. Wenn dieses Muster zutrifft, haben Sie definitiv die Ordnungszahl gefunden. - Sie können Lücken nach den Elementen 56 (Barium) und 88 (Radium) sehen. Es gibt keine tatsächliche Lücke; Die Elemente mit diesen Ordnungszahlen befinden sich in zwei Reihen unter dem Rest des Diagramms. Sie werden nur so getrennt, um dem Periodensystem in einer schmaleren Form zu passen.
-
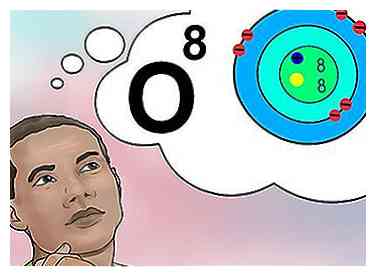 5 Die Ordnungszahl verstehen. Die Ordnungszahl eines Elements hat eine einfache Definition: die Anzahl der Protonen in einem Atom dieses Elements.[1] Dies ist die grundlegende Definition eines Elements. Die Anzahl der Protonen bestimmt die gesamte elektrische Ladung des Kerns, die bestimmt, wie viele Elektronen das Atom tragen kann. Da Elektronen für fast alle chemischen Wechselwirkungen verantwortlich sind, setzt die Ordnungszahl indirekt fast alle physikalischen und chemischen Eigenschaften des Elements.
5 Die Ordnungszahl verstehen. Die Ordnungszahl eines Elements hat eine einfache Definition: die Anzahl der Protonen in einem Atom dieses Elements.[1] Dies ist die grundlegende Definition eines Elements. Die Anzahl der Protonen bestimmt die gesamte elektrische Ladung des Kerns, die bestimmt, wie viele Elektronen das Atom tragen kann. Da Elektronen für fast alle chemischen Wechselwirkungen verantwortlich sind, setzt die Ordnungszahl indirekt fast alle physikalischen und chemischen Eigenschaften des Elements. - Anders ausgedrückt ist jedes Atom mit acht Protonen ein Sauerstoffatom. Zwei Sauerstoffatome können eine unterschiedliche Anzahl von Neutronen oder (wenn man ein Ion ist) eine unterschiedliche Anzahl von Elektronen haben, aber sie werden immer acht Protonen haben.
Teil zwei von zwei:
Zugehörige Informationen finden
-
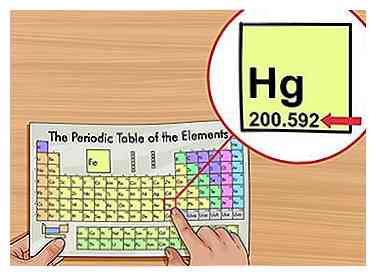 1 Finde das Atomgewicht. Das Atomgewicht wird normalerweise unterhalb des Elementnamens im Periodensystem gedruckt, normalerweise auf zwei oder drei Dezimalstellen. Dies ist die durchschnittliche Masse von einem Atom des Elements, gewichtet zu dem, was Sie in der Natur erwarten würden. Diese Nummer steht in "atomic mass units" (AMU).
1 Finde das Atomgewicht. Das Atomgewicht wird normalerweise unterhalb des Elementnamens im Periodensystem gedruckt, normalerweise auf zwei oder drei Dezimalstellen. Dies ist die durchschnittliche Masse von einem Atom des Elements, gewichtet zu dem, was Sie in der Natur erwarten würden. Diese Nummer steht in "atomic mass units" (AMU). - Manche Wissenschaftler bevorzugen den Begriff "relative Atommasse" anstelle von Atomgewicht.[2]
-
 2 Rund um die Massenzahl. Die Massenzahl ist die Gesamtzahl von Protonen und Neutronen in einem Atom eines Elements. Das ist leicht zu finden: Nimm das atomare Gewicht, das auf dem Periodensystem steht, und richte es auf die nächste ganze Zahl.[3]
2 Rund um die Massenzahl. Die Massenzahl ist die Gesamtzahl von Protonen und Neutronen in einem Atom eines Elements. Das ist leicht zu finden: Nimm das atomare Gewicht, das auf dem Periodensystem steht, und richte es auf die nächste ganze Zahl.[3] - Dies funktioniert, weil Neutronen und Protonen beide sehr nahe bei 1 AMU sind und Elektronen sehr nahe bei 0 AMU sind. Das Atomgewicht verwendet genaue Messungen, um den Dezimalwert zu erhalten, aber wir sind nur an den ganzen Zahlen interessiert, die uns die Anzahl der Protonen und Neutronen mitteilen.
- Denken Sie daran, wenn Sie das Atomgewicht verwenden, erhalten Sie einen Durchschnittswert für eine typische Probe. Eine Bromprobe hat eine durchschnittliche Massenzahl von 80, aber wie sich herausstellt, hat ein einzelnes Bromatom fast immer eine Massenzahl von 79 oder 81.[4]
- 3 Finde die Anzahl der Elektronen. Atome enthalten die gleiche Anzahl von Protonen und Elektronen, also sind diese Zahlen gleich. Elektronen sind negativ geladen, sie balancieren und neutralisieren die Protonen, die positiv geladen sind.[5]
- Wenn ein Atom Elektronen verliert oder gewinnt, wird es zu einem Ion, was bedeutet, dass es ein elektrisch geladenes Atom ist.
-
 4 Berechnen Sie die Anzahl der Neutronen. Jetzt kennen Sie die Ordnungszahl = Anzahl der Protonen und die Massenzahl = Anzahl der Protonen + Anzahl der Neutronen. Um die Anzahl der Neutronen in einem Element zu finden, subtrahieren Sie die Ordnungszahl von der Massenzahl. Hier ein paar Beispiele:
4 Berechnen Sie die Anzahl der Neutronen. Jetzt kennen Sie die Ordnungszahl = Anzahl der Protonen und die Massenzahl = Anzahl der Protonen + Anzahl der Neutronen. Um die Anzahl der Neutronen in einem Element zu finden, subtrahieren Sie die Ordnungszahl von der Massenzahl. Hier ein paar Beispiele: - Ein einzelnes Helium (He) Atom hat eine Massenzahl von 4 und eine Ordnungszahl von 2. Es muss 4 - 2 = haben 2 Neutronen.
- Eine Probe von Silber (Ag) hat eine durchschnittliche Massenzahl von 108 (basierend auf dem Periodensystem) und eine Ordnungszahl von 47. Im Durchschnitt hat jedes Silberatom in der Probe 108 - 47 = 61 Neutronen.
-
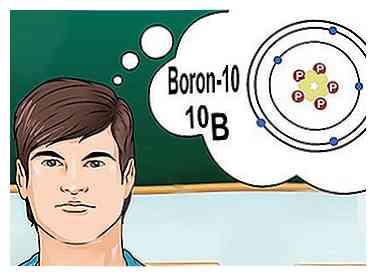 5 Isotope verstehen. Ein Isotop ist eine spezifische Form eines Elements mit einer bestimmten Anzahl von Neutronen. Wenn ein chemisches Problem "Bor-10" oder "Bor-10" erwähnt10B, "es geht um Borelemente mit einer Massenzahl von 10.[6] Verwenden Sie diese Massenzahl anstelle der Werte für "typisches" Bor.
5 Isotope verstehen. Ein Isotop ist eine spezifische Form eines Elements mit einer bestimmten Anzahl von Neutronen. Wenn ein chemisches Problem "Bor-10" oder "Bor-10" erwähnt10B, "es geht um Borelemente mit einer Massenzahl von 10.[6] Verwenden Sie diese Massenzahl anstelle der Werte für "typisches" Bor. - Isotope ändern niemals die Ordnungszahl. Jedes Isotop eines Elements hat die gleiche Anzahl von Protonen.
Facebook
Twitter
Google+
 Minotauromaquia
Minotauromaquia
 1 Suchen Sie eine Kopie des Periodensystems. Wir haben hier einen, wenn Sie keinen haben. Jedes einzelne Element hat eine andere Ordnungszahl, und die Elemente sind nach ihren Ordnungszahlen geordnet. Entweder man findet eine Kopie des Periodensystems oder man merkt sich eine.
1 Suchen Sie eine Kopie des Periodensystems. Wir haben hier einen, wenn Sie keinen haben. Jedes einzelne Element hat eine andere Ordnungszahl, und die Elemente sind nach ihren Ordnungszahlen geordnet. Entweder man findet eine Kopie des Periodensystems oder man merkt sich eine.  2 Finde das Element, das du studierst. Die meisten Periodentabellen enthalten den vollständigen Namen der Elemente sowie das chemische Symbol (z. B. Hg für Mercury). Wenn Sie Probleme haben, es zu finden, suchen Sie online nach "chemischen Symbol", gefolgt von dem Namen des Elements.
2 Finde das Element, das du studierst. Die meisten Periodentabellen enthalten den vollständigen Namen der Elemente sowie das chemische Symbol (z. B. Hg für Mercury). Wenn Sie Probleme haben, es zu finden, suchen Sie online nach "chemischen Symbol", gefolgt von dem Namen des Elements.  3 Suchen Sie nach der Ordnungszahl. Die Ordnungszahl befindet sich normalerweise in der oberen linken oder oberen rechten Ecke der Element-Box, aber sie könnte sich an einer anderen Stelle befinden. Dies ist immer eine ganze Zahl.
3 Suchen Sie nach der Ordnungszahl. Die Ordnungszahl befindet sich normalerweise in der oberen linken oder oberen rechten Ecke der Element-Box, aber sie könnte sich an einer anderen Stelle befinden. Dies ist immer eine ganze Zahl.  4 Bestätigen Sie anhand von Elementen in der Nähe. Das Periodensystem ist in der Reihenfolge der Ordnungszahl angeordnet. Wenn die Ordnungszahl Ihres Elements "33" ist, sollte das Element auf der linken Seite "32" und das Element auf der rechten Seite eine "34" haben. Wenn dieses Muster zutrifft, haben Sie definitiv die Ordnungszahl gefunden.
4 Bestätigen Sie anhand von Elementen in der Nähe. Das Periodensystem ist in der Reihenfolge der Ordnungszahl angeordnet. Wenn die Ordnungszahl Ihres Elements "33" ist, sollte das Element auf der linken Seite "32" und das Element auf der rechten Seite eine "34" haben. Wenn dieses Muster zutrifft, haben Sie definitiv die Ordnungszahl gefunden.  5 Die Ordnungszahl verstehen. Die Ordnungszahl eines Elements hat eine einfache Definition: die Anzahl der Protonen in einem Atom dieses Elements.[1] Dies ist die grundlegende Definition eines Elements. Die Anzahl der Protonen bestimmt die gesamte elektrische Ladung des Kerns, die bestimmt, wie viele Elektronen das Atom tragen kann. Da Elektronen für fast alle chemischen Wechselwirkungen verantwortlich sind, setzt die Ordnungszahl indirekt fast alle physikalischen und chemischen Eigenschaften des Elements.
5 Die Ordnungszahl verstehen. Die Ordnungszahl eines Elements hat eine einfache Definition: die Anzahl der Protonen in einem Atom dieses Elements.[1] Dies ist die grundlegende Definition eines Elements. Die Anzahl der Protonen bestimmt die gesamte elektrische Ladung des Kerns, die bestimmt, wie viele Elektronen das Atom tragen kann. Da Elektronen für fast alle chemischen Wechselwirkungen verantwortlich sind, setzt die Ordnungszahl indirekt fast alle physikalischen und chemischen Eigenschaften des Elements.  1 Finde das Atomgewicht. Das Atomgewicht wird normalerweise unterhalb des Elementnamens im Periodensystem gedruckt, normalerweise auf zwei oder drei Dezimalstellen. Dies ist die durchschnittliche Masse von einem Atom des Elements, gewichtet zu dem, was Sie in der Natur erwarten würden. Diese Nummer steht in "atomic mass units" (AMU).
1 Finde das Atomgewicht. Das Atomgewicht wird normalerweise unterhalb des Elementnamens im Periodensystem gedruckt, normalerweise auf zwei oder drei Dezimalstellen. Dies ist die durchschnittliche Masse von einem Atom des Elements, gewichtet zu dem, was Sie in der Natur erwarten würden. Diese Nummer steht in "atomic mass units" (AMU).  2 Rund um die Massenzahl. Die Massenzahl ist die Gesamtzahl von Protonen und Neutronen in einem Atom eines Elements. Das ist leicht zu finden: Nimm das atomare Gewicht, das auf dem Periodensystem steht, und richte es auf die nächste ganze Zahl.[3]
2 Rund um die Massenzahl. Die Massenzahl ist die Gesamtzahl von Protonen und Neutronen in einem Atom eines Elements. Das ist leicht zu finden: Nimm das atomare Gewicht, das auf dem Periodensystem steht, und richte es auf die nächste ganze Zahl.[3]  4 Berechnen Sie die Anzahl der Neutronen. Jetzt kennen Sie die Ordnungszahl = Anzahl der Protonen und die Massenzahl = Anzahl der Protonen + Anzahl der Neutronen. Um die Anzahl der Neutronen in einem Element zu finden, subtrahieren Sie die Ordnungszahl von der Massenzahl. Hier ein paar Beispiele:
4 Berechnen Sie die Anzahl der Neutronen. Jetzt kennen Sie die Ordnungszahl = Anzahl der Protonen und die Massenzahl = Anzahl der Protonen + Anzahl der Neutronen. Um die Anzahl der Neutronen in einem Element zu finden, subtrahieren Sie die Ordnungszahl von der Massenzahl. Hier ein paar Beispiele:  5 Isotope verstehen. Ein Isotop ist eine spezifische Form eines Elements mit einer bestimmten Anzahl von Neutronen. Wenn ein chemisches Problem "Bor-10" oder "Bor-10" erwähnt10B, "es geht um Borelemente mit einer Massenzahl von 10.[6] Verwenden Sie diese Massenzahl anstelle der Werte für "typisches" Bor.
5 Isotope verstehen. Ein Isotop ist eine spezifische Form eines Elements mit einer bestimmten Anzahl von Neutronen. Wenn ein chemisches Problem "Bor-10" oder "Bor-10" erwähnt10B, "es geht um Borelemente mit einer Massenzahl von 10.[6] Verwenden Sie diese Massenzahl anstelle der Werte für "typisches" Bor.