Die durchschnittliche atomare Masse ist keine direkte Messung eines einzelnen Atoms. Stattdessen ist es die durchschnittliche Masse pro Atom für eine typische Probe eines gegebenen Elements. Wenn Sie die Masse von Milliarden einzelner Atome messen könnten, könnten Sie diesen Wert genauso berechnen, wie Sie einen Durchschnitt finden würden. Glücklicherweise gibt es eine praktikablere Methode, die auf aufgezeichneten Informationen über die Seltenheit verschiedener Isotope beruht.
Teil eins von zwei:
Berechnung der durchschnittlichen atomaren Masse
-
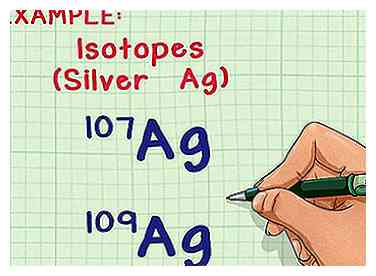 1 Isotope und atomare Massen verstehen. Die meisten Elemente können natürlich in mehreren Formen oder Isotopen vorkommen. Die Massenzahl für jedes Isotop ist die Summe der Anzahl von Protonen und Neutronen im Kern. Jedes Proton und jedes Neutron wiegen 1 atomare Masseneinheit (amu).[1] Der einzige Unterschied zwischen zwei Isotopen desselben Elements ist die Anzahl der Neutronen pro Atom, die die Masse des Atoms beeinflussen.[2] Das Element hat jedoch immer die gleiche Anzahl von Protonen.
1 Isotope und atomare Massen verstehen. Die meisten Elemente können natürlich in mehreren Formen oder Isotopen vorkommen. Die Massenzahl für jedes Isotop ist die Summe der Anzahl von Protonen und Neutronen im Kern. Jedes Proton und jedes Neutron wiegen 1 atomare Masseneinheit (amu).[1] Der einzige Unterschied zwischen zwei Isotopen desselben Elements ist die Anzahl der Neutronen pro Atom, die die Masse des Atoms beeinflussen.[2] Das Element hat jedoch immer die gleiche Anzahl von Protonen. - Die durchschnittliche atomare Masse des Elements berücksichtigt die Variationen der Anzahl der Neutronen und gibt die durchschnittliche Masse pro Atom in einer typischen Probe dieses Elements an.
- Zum Beispiel hat das Element Silber (Ag) zwei natürlich vorkommende Isotope: Ag-107 und Ag-109 (oder 107Ag und 109Ag).[3] Isotope sind nach der "Massenzahl" oder der Summe von Protonen und Neutronen in einem Atom benannt.[4] Das heißt, Ag-109 hat zwei weitere Neutronen pro Atom als Ag-107, was ihm etwas mehr Masse verleiht.
-
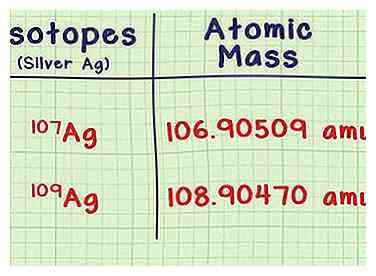 2 Schau dir die Masse jedes Isotops an. Für jedes Isotop benötigen Sie zwei Informationen, die Sie in einem Nachschlagewerk oder einer Online-Quelle wie webelements.com nachschlagen können. Die erste ist die Atommasse oder die Masse eines Atoms jedes Isotops. Isotope mit mehr Neutronen haben mehr Masse.
2 Schau dir die Masse jedes Isotops an. Für jedes Isotop benötigen Sie zwei Informationen, die Sie in einem Nachschlagewerk oder einer Online-Quelle wie webelements.com nachschlagen können. Die erste ist die Atommasse oder die Masse eines Atoms jedes Isotops. Isotope mit mehr Neutronen haben mehr Masse. - Zum Beispiel hat das Silberisotop Ag-107 eine Atommasse von 106.90509 amu (atomare Masseneinheiten). Das Isotop Ag-109 ist etwas schwerer mit einer Masse von 108.90470.
- Die letzten Dezimalstellen können in verschiedenen Quellen geringfügig abweichen. Geben Sie keine Zahlen in Klammern nach der Masse ein.
-
 3 Schreiben Sie die Häufigkeit jedes Isotops auf. Die Häufigkeit sagt Ihnen, wie häufig das Isotop ist, als Prozentsatz aller Atome des Elements. Jedes Isotop trägt proportional zu seiner Häufigkeit bei (je häufiger das Isotop vorhanden ist, desto mehr trägt es zur durchschnittlichen Atommasse bei). Sie können dies in derselben Quelle finden, in der Sie die Masse gefunden haben. Die Häufigkeiten aller Isotope sollten sich zu 100% addieren (obwohl sie aufgrund von Rundungsfehlern leicht abweichen könnte).
3 Schreiben Sie die Häufigkeit jedes Isotops auf. Die Häufigkeit sagt Ihnen, wie häufig das Isotop ist, als Prozentsatz aller Atome des Elements. Jedes Isotop trägt proportional zu seiner Häufigkeit bei (je häufiger das Isotop vorhanden ist, desto mehr trägt es zur durchschnittlichen Atommasse bei). Sie können dies in derselben Quelle finden, in der Sie die Masse gefunden haben. Die Häufigkeiten aller Isotope sollten sich zu 100% addieren (obwohl sie aufgrund von Rundungsfehlern leicht abweichen könnte). - Das Isotop Ag-107 hat eine Häufigkeit von 51,86%. Ag-109 ist etwas seltener mit einer Häufigkeit von 48,14%. Dies bedeutet, dass eine typische Silberprobe 51,86% Ag-107 und 48,14% Ag-109 ist.
- Ignoriere alle Isotope, die keine Häufigkeit aufweisen. Diese Isotope kommen nicht natürlich auf der Erde vor.
-
 4 Verwandle deine Häufigkeitsprozente in Dezimalzahlen. Teilen Sie den Abundanzprozentsatz durch 100, um den gleichen Wert wie eine Dezimalzahl zu erhalten.
4 Verwandle deine Häufigkeitsprozente in Dezimalzahlen. Teilen Sie den Abundanzprozentsatz durch 100, um den gleichen Wert wie eine Dezimalzahl zu erhalten. - In dem Beispielproblem sind die Häufigkeitszahlen 51,86 / 100 = 0.5186 und 48.14 / 100 = 0.4814.
-
 5 Finde den gewichteten Durchschnitt der Atommasse seiner stabilen Isotope. Die durchschnittliche Atommasse eines Elements mit n Isotope ist gleich (MasseIsotop 1 * FülleIsotop 1) + (MasseIsotop 2 * FülleIsotop 2) + ... + (MasseIsotop n * FülleIsotop n.[5] Dies ist ein Beispiel für einen "gewichteten Durchschnitt", was bedeutet, dass häufiger vorkommende (größere) Massen einen größeren Einfluss auf das Ergebnis haben. So verwenden Sie diese Formel für Silber:
5 Finde den gewichteten Durchschnitt der Atommasse seiner stabilen Isotope. Die durchschnittliche Atommasse eines Elements mit n Isotope ist gleich (MasseIsotop 1 * FülleIsotop 1) + (MasseIsotop 2 * FülleIsotop 2) + ... + (MasseIsotop n * FülleIsotop n.[5] Dies ist ein Beispiel für einen "gewichteten Durchschnitt", was bedeutet, dass häufiger vorkommende (größere) Massen einen größeren Einfluss auf das Ergebnis haben. So verwenden Sie diese Formel für Silber: - Durchschnittliche atomare MasseAg = (MasseAg-107 * FülleAg-107) + (MasseAg-109 * FülleAg-109)
=(106.90509 * 0.5186) + (108.90470 * 0.4814)
= 55.4410 + 52.4267
= 107,8677 amu. - Schlage das Element in einem Periodensystem nach, um deine Antwort zu überprüfen. Die durchschnittliche atomare Masse wird normalerweise unterhalb des Elementsymbols geschrieben.[6]
- Durchschnittliche atomare MasseAg = (MasseAg-107 * FülleAg-107) + (MasseAg-109 * FülleAg-109)
Teil zwei von zwei:
Verwenden des Ergebnisses
-
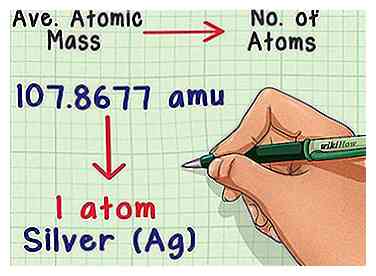 1 Konvertiere die Masse in die Anzahl der Atome. Die durchschnittliche Atommasse teilt Ihnen die Beziehung zwischen Masse und Anzahl der Atome in einer typischen Probe des Elements mit. Dies ist in Chemielabors nützlich, da es fast unmöglich ist, die Anzahl der Atome direkt zu zählen, sondern einfach die Masse zu messen. Zum Beispiel können Sie eine Probe von Silber wiegen und vorhersagen, dass jedes 107.8677 Amu der Masse ein Silberatom enthält.
1 Konvertiere die Masse in die Anzahl der Atome. Die durchschnittliche Atommasse teilt Ihnen die Beziehung zwischen Masse und Anzahl der Atome in einer typischen Probe des Elements mit. Dies ist in Chemielabors nützlich, da es fast unmöglich ist, die Anzahl der Atome direkt zu zählen, sondern einfach die Masse zu messen. Zum Beispiel können Sie eine Probe von Silber wiegen und vorhersagen, dass jedes 107.8677 Amu der Masse ein Silberatom enthält. -
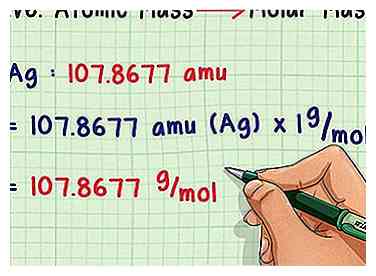 2 In molare Masse umrechnen. Atomare Masseneinheiten sind sehr klein, daher wiegen Chemiker typischerweise Proben in Gramm. Glücklicherweise sind diese Konzepte definiert, um die Konvertierung so einfach wie möglich zu machen. Multiplizieren Sie einfach die durchschnittliche atomare Masse mit 1 g / mol (die molare Massenkonstante), um stattdessen eine Antwort in g / mol zu erhalten. Zum Beispiel enthalten 107.8677 Gramm Silber durchschnittlich ein Mol Silberatome.
2 In molare Masse umrechnen. Atomare Masseneinheiten sind sehr klein, daher wiegen Chemiker typischerweise Proben in Gramm. Glücklicherweise sind diese Konzepte definiert, um die Konvertierung so einfach wie möglich zu machen. Multiplizieren Sie einfach die durchschnittliche atomare Masse mit 1 g / mol (die molare Massenkonstante), um stattdessen eine Antwort in g / mol zu erhalten. Zum Beispiel enthalten 107.8677 Gramm Silber durchschnittlich ein Mol Silberatome. -
 3 Finde die durchschnittliche Molekülmasse. Da ein Molekül nur eine Ansammlung von Atomen ist, können Sie die Massen der Atome addieren, um die Masse des Moleküls zu finden. Wenn Sie die durchschnittlichen atomaren Massen (anstelle der Masse eines spezifischen Isotops) verwenden, ist die Antwort die durchschnittliche Masse des Moleküls, wie sie in einer natürlich vorkommenden Probe gefunden wird. Hier ist ein Beispiel:
3 Finde die durchschnittliche Molekülmasse. Da ein Molekül nur eine Ansammlung von Atomen ist, können Sie die Massen der Atome addieren, um die Masse des Moleküls zu finden. Wenn Sie die durchschnittlichen atomaren Massen (anstelle der Masse eines spezifischen Isotops) verwenden, ist die Antwort die durchschnittliche Masse des Moleküls, wie sie in einer natürlich vorkommenden Probe gefunden wird. Hier ist ein Beispiel: - Ein Molekül Wasser hat die chemische Formel H2O, so enthält es zwei Wasserstoffatome (H) und ein Sauerstoffatom (O).
- Wasserstoff hat eine durchschnittliche Atommasse von 1,00794 amu. Sauerstoffatome haben eine durchschnittliche Masse von 15.9994 amu.
- Die durchschnittliche Masse eines Moleküls von H2O ist gleich (1,00794) (2) + 15,9994 = 18,01528 amu, was 18,01528 g / mol entspricht.
Facebook
Twitter
Google+
 Minotauromaquia
Minotauromaquia
 1 Isotope und atomare Massen verstehen. Die meisten Elemente können natürlich in mehreren Formen oder Isotopen vorkommen. Die Massenzahl für jedes Isotop ist die Summe der Anzahl von Protonen und Neutronen im Kern. Jedes Proton und jedes Neutron wiegen 1 atomare Masseneinheit (amu).[1] Der einzige Unterschied zwischen zwei Isotopen desselben Elements ist die Anzahl der Neutronen pro Atom, die die Masse des Atoms beeinflussen.[2] Das Element hat jedoch immer die gleiche Anzahl von Protonen.
1 Isotope und atomare Massen verstehen. Die meisten Elemente können natürlich in mehreren Formen oder Isotopen vorkommen. Die Massenzahl für jedes Isotop ist die Summe der Anzahl von Protonen und Neutronen im Kern. Jedes Proton und jedes Neutron wiegen 1 atomare Masseneinheit (amu).[1] Der einzige Unterschied zwischen zwei Isotopen desselben Elements ist die Anzahl der Neutronen pro Atom, die die Masse des Atoms beeinflussen.[2] Das Element hat jedoch immer die gleiche Anzahl von Protonen.  2 Schau dir die Masse jedes Isotops an. Für jedes Isotop benötigen Sie zwei Informationen, die Sie in einem Nachschlagewerk oder einer Online-Quelle wie webelements.com nachschlagen können. Die erste ist die Atommasse oder die Masse eines Atoms jedes Isotops. Isotope mit mehr Neutronen haben mehr Masse.
2 Schau dir die Masse jedes Isotops an. Für jedes Isotop benötigen Sie zwei Informationen, die Sie in einem Nachschlagewerk oder einer Online-Quelle wie webelements.com nachschlagen können. Die erste ist die Atommasse oder die Masse eines Atoms jedes Isotops. Isotope mit mehr Neutronen haben mehr Masse.  3 Schreiben Sie die Häufigkeit jedes Isotops auf. Die Häufigkeit sagt Ihnen, wie häufig das Isotop ist, als Prozentsatz aller Atome des Elements. Jedes Isotop trägt proportional zu seiner Häufigkeit bei (je häufiger das Isotop vorhanden ist, desto mehr trägt es zur durchschnittlichen Atommasse bei). Sie können dies in derselben Quelle finden, in der Sie die Masse gefunden haben. Die Häufigkeiten aller Isotope sollten sich zu 100% addieren (obwohl sie aufgrund von Rundungsfehlern leicht abweichen könnte).
3 Schreiben Sie die Häufigkeit jedes Isotops auf. Die Häufigkeit sagt Ihnen, wie häufig das Isotop ist, als Prozentsatz aller Atome des Elements. Jedes Isotop trägt proportional zu seiner Häufigkeit bei (je häufiger das Isotop vorhanden ist, desto mehr trägt es zur durchschnittlichen Atommasse bei). Sie können dies in derselben Quelle finden, in der Sie die Masse gefunden haben. Die Häufigkeiten aller Isotope sollten sich zu 100% addieren (obwohl sie aufgrund von Rundungsfehlern leicht abweichen könnte).  4 Verwandle deine Häufigkeitsprozente in Dezimalzahlen. Teilen Sie den Abundanzprozentsatz durch 100, um den gleichen Wert wie eine Dezimalzahl zu erhalten.
4 Verwandle deine Häufigkeitsprozente in Dezimalzahlen. Teilen Sie den Abundanzprozentsatz durch 100, um den gleichen Wert wie eine Dezimalzahl zu erhalten.  5 Finde den gewichteten Durchschnitt der Atommasse seiner stabilen Isotope. Die durchschnittliche Atommasse eines Elements mit n Isotope ist gleich (MasseIsotop 1 * FülleIsotop 1) + (MasseIsotop 2 * FülleIsotop 2) + ... + (MasseIsotop n * FülleIsotop n.[5] Dies ist ein Beispiel für einen "gewichteten Durchschnitt", was bedeutet, dass häufiger vorkommende (größere) Massen einen größeren Einfluss auf das Ergebnis haben. So verwenden Sie diese Formel für Silber:
5 Finde den gewichteten Durchschnitt der Atommasse seiner stabilen Isotope. Die durchschnittliche Atommasse eines Elements mit n Isotope ist gleich (MasseIsotop 1 * FülleIsotop 1) + (MasseIsotop 2 * FülleIsotop 2) + ... + (MasseIsotop n * FülleIsotop n.[5] Dies ist ein Beispiel für einen "gewichteten Durchschnitt", was bedeutet, dass häufiger vorkommende (größere) Massen einen größeren Einfluss auf das Ergebnis haben. So verwenden Sie diese Formel für Silber:  1 Konvertiere die Masse in die Anzahl der Atome. Die durchschnittliche Atommasse teilt Ihnen die Beziehung zwischen Masse und Anzahl der Atome in einer typischen Probe des Elements mit. Dies ist in Chemielabors nützlich, da es fast unmöglich ist, die Anzahl der Atome direkt zu zählen, sondern einfach die Masse zu messen. Zum Beispiel können Sie eine Probe von Silber wiegen und vorhersagen, dass jedes 107.8677 Amu der Masse ein Silberatom enthält.
1 Konvertiere die Masse in die Anzahl der Atome. Die durchschnittliche Atommasse teilt Ihnen die Beziehung zwischen Masse und Anzahl der Atome in einer typischen Probe des Elements mit. Dies ist in Chemielabors nützlich, da es fast unmöglich ist, die Anzahl der Atome direkt zu zählen, sondern einfach die Masse zu messen. Zum Beispiel können Sie eine Probe von Silber wiegen und vorhersagen, dass jedes 107.8677 Amu der Masse ein Silberatom enthält. 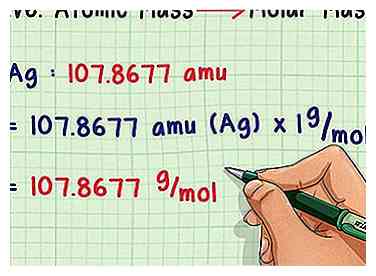 2 In molare Masse umrechnen. Atomare Masseneinheiten sind sehr klein, daher wiegen Chemiker typischerweise Proben in Gramm. Glücklicherweise sind diese Konzepte definiert, um die Konvertierung so einfach wie möglich zu machen. Multiplizieren Sie einfach die durchschnittliche atomare Masse mit 1 g / mol (die molare Massenkonstante), um stattdessen eine Antwort in g / mol zu erhalten. Zum Beispiel enthalten 107.8677 Gramm Silber durchschnittlich ein Mol Silberatome.
2 In molare Masse umrechnen. Atomare Masseneinheiten sind sehr klein, daher wiegen Chemiker typischerweise Proben in Gramm. Glücklicherweise sind diese Konzepte definiert, um die Konvertierung so einfach wie möglich zu machen. Multiplizieren Sie einfach die durchschnittliche atomare Masse mit 1 g / mol (die molare Massenkonstante), um stattdessen eine Antwort in g / mol zu erhalten. Zum Beispiel enthalten 107.8677 Gramm Silber durchschnittlich ein Mol Silberatome.  3 Finde die durchschnittliche Molekülmasse. Da ein Molekül nur eine Ansammlung von Atomen ist, können Sie die Massen der Atome addieren, um die Masse des Moleküls zu finden. Wenn Sie die durchschnittlichen atomaren Massen (anstelle der Masse eines spezifischen Isotops) verwenden, ist die Antwort die durchschnittliche Masse des Moleküls, wie sie in einer natürlich vorkommenden Probe gefunden wird. Hier ist ein Beispiel:
3 Finde die durchschnittliche Molekülmasse. Da ein Molekül nur eine Ansammlung von Atomen ist, können Sie die Massen der Atome addieren, um die Masse des Moleküls zu finden. Wenn Sie die durchschnittlichen atomaren Massen (anstelle der Masse eines spezifischen Isotops) verwenden, ist die Antwort die durchschnittliche Masse des Moleküls, wie sie in einer natürlich vorkommenden Probe gefunden wird. Hier ist ein Beispiel: