Wenn du Hausaufgaben bekommen hast, wo du die empirische Formel einer Verbindung finden musst, aber du keine Ahnung hast, wie du anfangen sollst, fürchte dich nie! wikiHow ist hier um zu helfen! Sehen Sie sich zunächst das Grundwissen an, das Sie zum Auffinden der empirischen Formel benötigen, und gehen Sie dann durch ein Beispiel in Teil 2.
Methode eins von zwei:
Die Grundlagen verstehen
-
 1 Wissen Sie, was die empirische Formel ist. In der Chemie ist die EF die einfachste Art, eine Verbindung zu beschreiben - sie ist im Grunde eine Liste der Elemente, aus denen eine Verbindung besteht, geordnet nach Prozenten. Es ist wichtig zu beachten, dass diese einfache Formel das nicht beschreibt Anordnung Von den Atomen innerhalb der Verbindung gibt es einfach an, aus welchen Elementen die Verbindung besteht. Beispielsweise:
1 Wissen Sie, was die empirische Formel ist. In der Chemie ist die EF die einfachste Art, eine Verbindung zu beschreiben - sie ist im Grunde eine Liste der Elemente, aus denen eine Verbindung besteht, geordnet nach Prozenten. Es ist wichtig zu beachten, dass diese einfache Formel das nicht beschreibt Anordnung Von den Atomen innerhalb der Verbindung gibt es einfach an, aus welchen Elementen die Verbindung besteht. Beispielsweise: - Eine Verbindung, die aus 40,92% Kohlenstoff, 4,58% Wasserstoff und 54,5% Sauerstoff besteht, hätte eine empirische Formel von C3H4O3 (Wir werden ein Beispiel durchgehen, um das EF dieser Verbindung im zweiten Teil zu finden).
-
 2 Verstehen Sie den Begriff "prozentuale Zusammensetzung". "Prozentuale Zusammensetzung" bezieht sich auf den Prozentsatz jedes einzelnen Atoms in der gesamten Verbindung, die wir betrachten. Um die empirische Formel einer Verbindung zu finden, müssen wir die prozentuale Zusammensetzung der Verbindung kennen. Wenn Sie die empirische Formel für Hausaufgaben finden, werden Sie höchstwahrscheinlich die Prozentsätze erhalten.
2 Verstehen Sie den Begriff "prozentuale Zusammensetzung". "Prozentuale Zusammensetzung" bezieht sich auf den Prozentsatz jedes einzelnen Atoms in der gesamten Verbindung, die wir betrachten. Um die empirische Formel einer Verbindung zu finden, müssen wir die prozentuale Zusammensetzung der Verbindung kennen. Wenn Sie die empirische Formel für Hausaufgaben finden, werden Sie höchstwahrscheinlich die Prozentsätze erhalten. - Um in einem Chemielabor die prozentuale Zusammensetzung zu finden, würde die Verbindung durch einige physikalische Experimente und dann durch quantitative Analyse untersucht werden. Wenn Sie nicht in einem Labor sind, müssen Sie diese Experimente nicht durchführen.
-
 3 Seien Sie sich bewusst, dass Sie sich mit Grammatomen beschäftigen werden. Ein Grammatom ist die spezifische Menge eines Elements, dessen Gewicht in Gramm seiner Atommasse entspricht. Um ein Grammatom zu finden, lautet die Gleichung: Der Prozentsatz des Elements in der Verbindung (%) geteilt durch die Atommasse des Elements.[1]
3 Seien Sie sich bewusst, dass Sie sich mit Grammatomen beschäftigen werden. Ein Grammatom ist die spezifische Menge eines Elements, dessen Gewicht in Gramm seiner Atommasse entspricht. Um ein Grammatom zu finden, lautet die Gleichung: Der Prozentsatz des Elements in der Verbindung (%) geteilt durch die Atommasse des Elements.[1] - Nehmen wir zum Beispiel an, dass wir eine Verbindung haben, die aus 40,92% Kohlenstoff besteht. Die Atommasse von Kohlenstoff ist 12, also wäre unsere Gleichung 40.92 / 12 = 3.41.
-
 4 Wissen, wie man das Atomverhältnis findet. Wenn Sie mit einer Verbindung arbeiten, müssen Sie mehr als ein Gramm Atom berechnen. Nachdem Sie alle Grammatome in Ihrer Verbindung gefunden haben, sehen Sie sich alle an. Um das Atomverhältnis zu finden, müssen Sie das Grammatom auswählen, das das kleinste von allen Grammatomen ist, die Sie berechnet haben. Sie werden dann alle Ihre Grammatome durch das kleinste Grammatom teilen. Beispielsweise:
4 Wissen, wie man das Atomverhältnis findet. Wenn Sie mit einer Verbindung arbeiten, müssen Sie mehr als ein Gramm Atom berechnen. Nachdem Sie alle Grammatome in Ihrer Verbindung gefunden haben, sehen Sie sich alle an. Um das Atomverhältnis zu finden, müssen Sie das Grammatom auswählen, das das kleinste von allen Grammatomen ist, die Sie berechnet haben. Sie werden dann alle Ihre Grammatome durch das kleinste Grammatom teilen. Beispielsweise: - Nehmen wir an, wir arbeiten mit einer Verbindung, die drei Gramm Atome hat: 1,5, 2 und 2,5. Das kleinste Grammatom von diesen drei Zahlen ist 1,5. Um also das Atomverhältnis zu finden, müssen Sie alle Zahlen durch 1,5 teilen und sie dann mit dem Symbol für das Verhältnis trennen :.
- 1,5 / 1,5 = 1. 2 / 1,5 = 1,33. 2,5 / 1,5 = 1,66. Also dein Atomverhältnis ist 1 : 1.33 : 1.66.
-
 5 Verstehen, wie man Atomzahlen in ganze Zahlen umwandelt. Wenn Sie eine empirische Formel schreiben, benötigen Sie ganze Zahlen. Dies bedeutet, dass Sie keine Nummer wie 1.33 verwenden können. Nachdem Sie Ihr Atomverhältnis gefunden haben, müssen Sie alle Teilzahlen (wieder wie 1,33) in ganze Zahlen (wie 3) konvertieren. Dazu müssen Sie eine ganze Zahl finden, die mit jeder einzelnen Zahl in Ihrem Atomverhältnis multipliziert werden kann, um eine ganze Zahl zu erhalten. Beispielsweise:
5 Verstehen, wie man Atomzahlen in ganze Zahlen umwandelt. Wenn Sie eine empirische Formel schreiben, benötigen Sie ganze Zahlen. Dies bedeutet, dass Sie keine Nummer wie 1.33 verwenden können. Nachdem Sie Ihr Atomverhältnis gefunden haben, müssen Sie alle Teilzahlen (wieder wie 1,33) in ganze Zahlen (wie 3) konvertieren. Dazu müssen Sie eine ganze Zahl finden, die mit jeder einzelnen Zahl in Ihrem Atomverhältnis multipliziert werden kann, um eine ganze Zahl zu erhalten. Beispielsweise: - Versuchen Sie 2. Multiplizieren Sie die Zahlen in Ihrem Atomverhältnis (1, 1.33 und 1.66) mit 2. Sie erhalten 2, 2.66 und 3.32. Das sind keine ganzen Zahlen, also funktioniert 2 nicht.
- Versuchen Sie 3. Sie erhalten 3, 4 und 5, wenn Sie 1, 1,33 und 1,66 mit 3 multiplizieren. Daher ist Ihr Atomverhältnis von ganzen Zahlen 3 : 4 : 5.
-
 6 Verstehen Sie, was diese ganzen Zahlen für die empirische Formel bedeuten. Das ganze Zahlenverhältnis, das wir gerade gelöst haben, passt tatsächlich zur empirischen Formel. Diese drei ganzen Zahlen sind die kleinen Zahlen, die am Fuß jedes Buchstabens hängen, der ein separates Element der Verbindung darstellt. Zum Beispiel würde unsere erfundene empirische Formel wie folgt aussehen:
6 Verstehen Sie, was diese ganzen Zahlen für die empirische Formel bedeuten. Das ganze Zahlenverhältnis, das wir gerade gelöst haben, passt tatsächlich zur empirischen Formel. Diese drei ganzen Zahlen sind die kleinen Zahlen, die am Fuß jedes Buchstabens hängen, der ein separates Element der Verbindung darstellt. Zum Beispiel würde unsere erfundene empirische Formel wie folgt aussehen: - X3Y4Z5
Methode zwei von zwei:
Die empirische Formel finden
-
 1 Ermitteln Sie die prozentuale Zusammensetzung Ihrer Verbindung. Wenn Sie versuchen, die empirische Formel für eine Hausaufgabe zu finden, werden Sie höchstwahrscheinlich die prozentuale Zusammensetzung erhalten - Sie müssen nur wissen, wo Sie suchen müssen. Beispielsweise:
1 Ermitteln Sie die prozentuale Zusammensetzung Ihrer Verbindung. Wenn Sie versuchen, die empirische Formel für eine Hausaufgabe zu finden, werden Sie höchstwahrscheinlich die prozentuale Zusammensetzung erhalten - Sie müssen nur wissen, wo Sie suchen müssen. Beispielsweise: - Lassen Sie uns sagen, dass die Aufgabe Sie bittet, eine Probe von Vitamin C zu betrachten. Es listet 40,92% Kohlenstoff, 4,58% Wasserstoff 54,5% Sauerstoff auf - das ist die prozentuale Zusammensetzung.
- 40,92% des Vitamin C besteht aus Kohlenstoff, der Rest besteht aus 4,58% Wasserstoff und 54,5% Sauerstoff.
-
 2 Finde die Anzahl der Grammatome in der Verbindung. Wie in Teil 1 diskutiert, lautet die Gleichung zum Auffinden der Anzahl von Grammatomen: Der Prozentsatz des Elements in der Verbindung (%) geteilt durch die Atommasse des Elements. Für unser Beispiel ist die Atommasse von Kohlenstoff 12, Wasserstoff ist 1 und Sauerstoff ist 16.
2 Finde die Anzahl der Grammatome in der Verbindung. Wie in Teil 1 diskutiert, lautet die Gleichung zum Auffinden der Anzahl von Grammatomen: Der Prozentsatz des Elements in der Verbindung (%) geteilt durch die Atommasse des Elements. Für unser Beispiel ist die Atommasse von Kohlenstoff 12, Wasserstoff ist 1 und Sauerstoff ist 16. - Anzahl der Grammatome von Kohlenstoff = 40,92 / 12 = 3,41
- Anzahl der Grammatome Wasserstoff = 04.58 / 01 = 4.58
- Anzahl der Grammatome Sauerstoff = 54,50 / 16 = 3,41
-
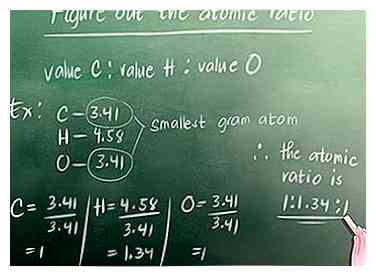 3 Ermitteln Sie das Atomverhältnis. Suchen Sie nach dem Grammatom, das das kleinste aller Grammatome ist, die wir gerade berechnet haben. Für unser Beispiel ist das 3,41 (Kohlenstoff oder Sauerstoff - beide haben den gleichen Wert). Sie müssen dann alle Grammatom-Werte durch diese Zahl teilen. Sie schreiben das Verhältnis so: Wert Kohlenstoff: Wert Wasserstoff: Wert Sauerstoff.
3 Ermitteln Sie das Atomverhältnis. Suchen Sie nach dem Grammatom, das das kleinste aller Grammatome ist, die wir gerade berechnet haben. Für unser Beispiel ist das 3,41 (Kohlenstoff oder Sauerstoff - beide haben den gleichen Wert). Sie müssen dann alle Grammatom-Werte durch diese Zahl teilen. Sie schreiben das Verhältnis so: Wert Kohlenstoff: Wert Wasserstoff: Wert Sauerstoff. - Kohlenstoff: 3,41 / 3,41 = 1
- Wasserstoff: 4,58 / 3,41 = 1,34
- Sauerstoff: 3,41 / 3,41 = 1
- Das Atomverhältnis ist 1 : 1.34 : 1.
-
 4 Konvertieren Sie das Verhältnis in ganze Zahlen. Wenn Ihr Atomverhältnis ganze Zahlen hat, können Sie diesen Schritt überspringen. In unserem Beispiel müssen wir jedoch 1,34 in eine ganze Zahl umwandeln.Unsere kleinste ganze Zahl, die mit den Zahlen in unserem Atomverhältnis multipliziert werden kann, um ganze Zahlen zu erzeugen, ist 3.
4 Konvertieren Sie das Verhältnis in ganze Zahlen. Wenn Ihr Atomverhältnis ganze Zahlen hat, können Sie diesen Schritt überspringen. In unserem Beispiel müssen wir jedoch 1,34 in eine ganze Zahl umwandeln.Unsere kleinste ganze Zahl, die mit den Zahlen in unserem Atomverhältnis multipliziert werden kann, um ganze Zahlen zu erzeugen, ist 3. - 1 x 3 = 3 (das funktioniert, weil 3 eine ganze Zahl ist).
- 1,34 x 3 = 4 (4 ist auch eine ganze Zahl).
- 1 x 3 = 3 (wiederum ist 3 eine ganze Zahl).
- Unser ganzzahliges Verhältnis ist daher Kohlenstoff (C): Wasserstoff (H): Sauerstoff (O) = 3 : 4 : 3
-
 5 Schreiben Sie die empirische Formel auf. Um dies zu tun, müssen Sie nur die Buchstaben jeder Komponente schreiben, in diesem Fall C für Kohlenstoff, H für Wasserstoff und O für Sauerstoff, mit ihren ganzzahligen Zähler-Teilen als Indizes. Die empirische Formel für unser Beispiel lautet:
5 Schreiben Sie die empirische Formel auf. Um dies zu tun, müssen Sie nur die Buchstaben jeder Komponente schreiben, in diesem Fall C für Kohlenstoff, H für Wasserstoff und O für Sauerstoff, mit ihren ganzzahligen Zähler-Teilen als Indizes. Die empirische Formel für unser Beispiel lautet: - C3H4O3
Facebook
Twitter
Google+
 Minotauromaquia
Minotauromaquia
 1 Wissen Sie, was die empirische Formel ist. In der Chemie ist die EF die einfachste Art, eine Verbindung zu beschreiben - sie ist im Grunde eine Liste der Elemente, aus denen eine Verbindung besteht, geordnet nach Prozenten. Es ist wichtig zu beachten, dass diese einfache Formel das nicht beschreibt Anordnung Von den Atomen innerhalb der Verbindung gibt es einfach an, aus welchen Elementen die Verbindung besteht. Beispielsweise:
1 Wissen Sie, was die empirische Formel ist. In der Chemie ist die EF die einfachste Art, eine Verbindung zu beschreiben - sie ist im Grunde eine Liste der Elemente, aus denen eine Verbindung besteht, geordnet nach Prozenten. Es ist wichtig zu beachten, dass diese einfache Formel das nicht beschreibt Anordnung Von den Atomen innerhalb der Verbindung gibt es einfach an, aus welchen Elementen die Verbindung besteht. Beispielsweise:  2 Verstehen Sie den Begriff "prozentuale Zusammensetzung". "Prozentuale Zusammensetzung" bezieht sich auf den Prozentsatz jedes einzelnen Atoms in der gesamten Verbindung, die wir betrachten. Um die empirische Formel einer Verbindung zu finden, müssen wir die prozentuale Zusammensetzung der Verbindung kennen. Wenn Sie die empirische Formel für Hausaufgaben finden, werden Sie höchstwahrscheinlich die Prozentsätze erhalten.
2 Verstehen Sie den Begriff "prozentuale Zusammensetzung". "Prozentuale Zusammensetzung" bezieht sich auf den Prozentsatz jedes einzelnen Atoms in der gesamten Verbindung, die wir betrachten. Um die empirische Formel einer Verbindung zu finden, müssen wir die prozentuale Zusammensetzung der Verbindung kennen. Wenn Sie die empirische Formel für Hausaufgaben finden, werden Sie höchstwahrscheinlich die Prozentsätze erhalten.  3 Seien Sie sich bewusst, dass Sie sich mit Grammatomen beschäftigen werden. Ein Grammatom ist die spezifische Menge eines Elements, dessen Gewicht in Gramm seiner Atommasse entspricht. Um ein Grammatom zu finden, lautet die Gleichung: Der Prozentsatz des Elements in der Verbindung (%) geteilt durch die Atommasse des Elements.[1]
3 Seien Sie sich bewusst, dass Sie sich mit Grammatomen beschäftigen werden. Ein Grammatom ist die spezifische Menge eines Elements, dessen Gewicht in Gramm seiner Atommasse entspricht. Um ein Grammatom zu finden, lautet die Gleichung: Der Prozentsatz des Elements in der Verbindung (%) geteilt durch die Atommasse des Elements.[1]  4 Wissen, wie man das Atomverhältnis findet. Wenn Sie mit einer Verbindung arbeiten, müssen Sie mehr als ein Gramm Atom berechnen. Nachdem Sie alle Grammatome in Ihrer Verbindung gefunden haben, sehen Sie sich alle an. Um das Atomverhältnis zu finden, müssen Sie das Grammatom auswählen, das das kleinste von allen Grammatomen ist, die Sie berechnet haben. Sie werden dann alle Ihre Grammatome durch das kleinste Grammatom teilen. Beispielsweise:
4 Wissen, wie man das Atomverhältnis findet. Wenn Sie mit einer Verbindung arbeiten, müssen Sie mehr als ein Gramm Atom berechnen. Nachdem Sie alle Grammatome in Ihrer Verbindung gefunden haben, sehen Sie sich alle an. Um das Atomverhältnis zu finden, müssen Sie das Grammatom auswählen, das das kleinste von allen Grammatomen ist, die Sie berechnet haben. Sie werden dann alle Ihre Grammatome durch das kleinste Grammatom teilen. Beispielsweise:  5 Verstehen, wie man Atomzahlen in ganze Zahlen umwandelt. Wenn Sie eine empirische Formel schreiben, benötigen Sie ganze Zahlen. Dies bedeutet, dass Sie keine Nummer wie 1.33 verwenden können. Nachdem Sie Ihr Atomverhältnis gefunden haben, müssen Sie alle Teilzahlen (wieder wie 1,33) in ganze Zahlen (wie 3) konvertieren. Dazu müssen Sie eine ganze Zahl finden, die mit jeder einzelnen Zahl in Ihrem Atomverhältnis multipliziert werden kann, um eine ganze Zahl zu erhalten. Beispielsweise:
5 Verstehen, wie man Atomzahlen in ganze Zahlen umwandelt. Wenn Sie eine empirische Formel schreiben, benötigen Sie ganze Zahlen. Dies bedeutet, dass Sie keine Nummer wie 1.33 verwenden können. Nachdem Sie Ihr Atomverhältnis gefunden haben, müssen Sie alle Teilzahlen (wieder wie 1,33) in ganze Zahlen (wie 3) konvertieren. Dazu müssen Sie eine ganze Zahl finden, die mit jeder einzelnen Zahl in Ihrem Atomverhältnis multipliziert werden kann, um eine ganze Zahl zu erhalten. Beispielsweise:  6 Verstehen Sie, was diese ganzen Zahlen für die empirische Formel bedeuten. Das ganze Zahlenverhältnis, das wir gerade gelöst haben, passt tatsächlich zur empirischen Formel. Diese drei ganzen Zahlen sind die kleinen Zahlen, die am Fuß jedes Buchstabens hängen, der ein separates Element der Verbindung darstellt. Zum Beispiel würde unsere erfundene empirische Formel wie folgt aussehen:
6 Verstehen Sie, was diese ganzen Zahlen für die empirische Formel bedeuten. Das ganze Zahlenverhältnis, das wir gerade gelöst haben, passt tatsächlich zur empirischen Formel. Diese drei ganzen Zahlen sind die kleinen Zahlen, die am Fuß jedes Buchstabens hängen, der ein separates Element der Verbindung darstellt. Zum Beispiel würde unsere erfundene empirische Formel wie folgt aussehen:  1 Ermitteln Sie die prozentuale Zusammensetzung Ihrer Verbindung. Wenn Sie versuchen, die empirische Formel für eine Hausaufgabe zu finden, werden Sie höchstwahrscheinlich die prozentuale Zusammensetzung erhalten - Sie müssen nur wissen, wo Sie suchen müssen. Beispielsweise:
1 Ermitteln Sie die prozentuale Zusammensetzung Ihrer Verbindung. Wenn Sie versuchen, die empirische Formel für eine Hausaufgabe zu finden, werden Sie höchstwahrscheinlich die prozentuale Zusammensetzung erhalten - Sie müssen nur wissen, wo Sie suchen müssen. Beispielsweise:  2 Finde die Anzahl der Grammatome in der Verbindung. Wie in Teil 1 diskutiert, lautet die Gleichung zum Auffinden der Anzahl von Grammatomen: Der Prozentsatz des Elements in der Verbindung (%) geteilt durch die Atommasse des Elements. Für unser Beispiel ist die Atommasse von Kohlenstoff 12, Wasserstoff ist 1 und Sauerstoff ist 16.
2 Finde die Anzahl der Grammatome in der Verbindung. Wie in Teil 1 diskutiert, lautet die Gleichung zum Auffinden der Anzahl von Grammatomen: Der Prozentsatz des Elements in der Verbindung (%) geteilt durch die Atommasse des Elements. Für unser Beispiel ist die Atommasse von Kohlenstoff 12, Wasserstoff ist 1 und Sauerstoff ist 16. 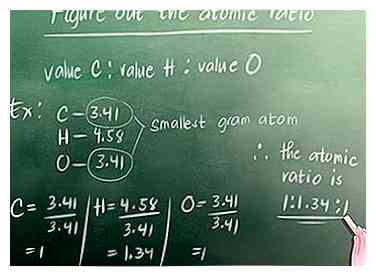 3 Ermitteln Sie das Atomverhältnis. Suchen Sie nach dem Grammatom, das das kleinste aller Grammatome ist, die wir gerade berechnet haben. Für unser Beispiel ist das 3,41 (Kohlenstoff oder Sauerstoff - beide haben den gleichen Wert). Sie müssen dann alle Grammatom-Werte durch diese Zahl teilen. Sie schreiben das Verhältnis so: Wert Kohlenstoff: Wert Wasserstoff: Wert Sauerstoff.
3 Ermitteln Sie das Atomverhältnis. Suchen Sie nach dem Grammatom, das das kleinste aller Grammatome ist, die wir gerade berechnet haben. Für unser Beispiel ist das 3,41 (Kohlenstoff oder Sauerstoff - beide haben den gleichen Wert). Sie müssen dann alle Grammatom-Werte durch diese Zahl teilen. Sie schreiben das Verhältnis so: Wert Kohlenstoff: Wert Wasserstoff: Wert Sauerstoff.  4 Konvertieren Sie das Verhältnis in ganze Zahlen. Wenn Ihr Atomverhältnis ganze Zahlen hat, können Sie diesen Schritt überspringen. In unserem Beispiel müssen wir jedoch 1,34 in eine ganze Zahl umwandeln.Unsere kleinste ganze Zahl, die mit den Zahlen in unserem Atomverhältnis multipliziert werden kann, um ganze Zahlen zu erzeugen, ist 3.
4 Konvertieren Sie das Verhältnis in ganze Zahlen. Wenn Ihr Atomverhältnis ganze Zahlen hat, können Sie diesen Schritt überspringen. In unserem Beispiel müssen wir jedoch 1,34 in eine ganze Zahl umwandeln.Unsere kleinste ganze Zahl, die mit den Zahlen in unserem Atomverhältnis multipliziert werden kann, um ganze Zahlen zu erzeugen, ist 3.  5 Schreiben Sie die empirische Formel auf. Um dies zu tun, müssen Sie nur die Buchstaben jeder Komponente schreiben, in diesem Fall C für Kohlenstoff, H für Wasserstoff und O für Sauerstoff, mit ihren ganzzahligen Zähler-Teilen als Indizes. Die empirische Formel für unser Beispiel lautet:
5 Schreiben Sie die empirische Formel auf. Um dies zu tun, müssen Sie nur die Buchstaben jeder Komponente schreiben, in diesem Fall C für Kohlenstoff, H für Wasserstoff und O für Sauerstoff, mit ihren ganzzahligen Zähler-Teilen als Indizes. Die empirische Formel für unser Beispiel lautet: