Die Anzahl der Protonen, Neutronen und Elektronen in einem gegebenen Element zu finden, ist nicht so schwer wie es klingt. Oft wird ein Teil Ihrer Antwort direkt vor Ihnen im Periodensystem sein! Sobald Sie wissen, wo Sie suchen müssen, wird es ein Kinderspiel sein, die Anzahl der Protonen, Neutronen und Elektronen zu finden.
Teil eins von zwei:
Berechnung von Protonen, Elektronen und Neutronen
-
 1 Holen Sie sich ein Periodensystem von Elementen. Das Periodensystem ist ein Diagramm, das Elemente nach ihrer atomaren Struktur organisiert. Es ist farbcodiert und weist jedem Element eine ein- oder zweistellige Abkürzung zu. Andere Elementarinformationen umfassen das Atomgewicht und die Ordnungszahl.[1]
1 Holen Sie sich ein Periodensystem von Elementen. Das Periodensystem ist ein Diagramm, das Elemente nach ihrer atomaren Struktur organisiert. Es ist farbcodiert und weist jedem Element eine ein- oder zweistellige Abkürzung zu. Andere Elementarinformationen umfassen das Atomgewicht und die Ordnungszahl.[1] - Sie können ein Periodensystem online oder in einem Chemiebuch finden.
- In Tests wird normalerweise ein Periodensystem bereitgestellt.
-
 2 Finden Sie Ihr Element im Periodensystem. Die Tabelle ordnet die Elemente nach ihrer Ordnungszahl an und unterteilt sie in drei Hauptgruppen: Metalle, Nichtmetalle und Halbmetalle (Halbmetalle). Weitere elementare Gruppierungen umfassen Alkalimetalle, Halogene und Edelgase.[2]
2 Finden Sie Ihr Element im Periodensystem. Die Tabelle ordnet die Elemente nach ihrer Ordnungszahl an und unterteilt sie in drei Hauptgruppen: Metalle, Nichtmetalle und Halbmetalle (Halbmetalle). Weitere elementare Gruppierungen umfassen Alkalimetalle, Halogene und Edelgase.[2] - Durch die Verwendung der Gruppe (Spalten) oder der Periode (Zeilen) kann das Element leichter in der Tabelle gefunden werden.
- Sie können die Tabelle auch nach dem Symbol des Elements durchsuchen, wenn Sie keine anderen Eigenschaften kennen.
-
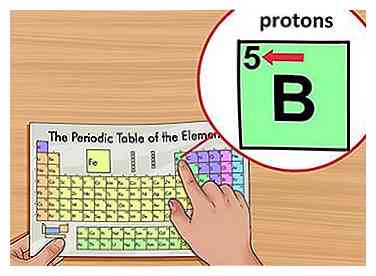 3 Suchen Sie die Ordnungszahl des Elements. Die Ordnungszahl befindet sich oberhalb des Elementsymbols in der oberen linken Ecke des Quadrats. Die Ordnungszahl sagt Ihnen, wie viele Protonen ein einzelnes Atom eines Elements ausmachen.[3]
3 Suchen Sie die Ordnungszahl des Elements. Die Ordnungszahl befindet sich oberhalb des Elementsymbols in der oberen linken Ecke des Quadrats. Die Ordnungszahl sagt Ihnen, wie viele Protonen ein einzelnes Atom eines Elements ausmachen.[3] - Zum Beispiel hat Bor (B) eine Ordnungszahl von 5, daher hat es 5 Protonen.
-
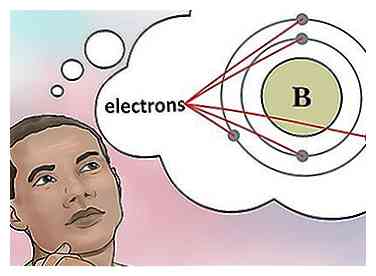 4 Bestimmen Sie die Anzahl der Elektronen. Protonen sind Teilchen im Kern eines Atoms, die eine positive Ladung von +1 haben. Elektronen sind Teilchen, die eine negative Ladung von -1 haben. Daher wird ein Element in einem neutralen Zustand die gleiche Anzahl von Protonen und Elektronen haben.
4 Bestimmen Sie die Anzahl der Elektronen. Protonen sind Teilchen im Kern eines Atoms, die eine positive Ladung von +1 haben. Elektronen sind Teilchen, die eine negative Ladung von -1 haben. Daher wird ein Element in einem neutralen Zustand die gleiche Anzahl von Protonen und Elektronen haben. - Zum Beispiel hat Bor (B) eine Ordnungszahl von 5, daher hat es 5 Protonen und 5 Elektronen.
- Wenn das Element jedoch ein negatives oder positives Ion enthält, sind die Protonen und Elektronen nicht gleich. Sie müssen sie berechnen. Die Ionennummer erscheint als kleines hochgestelltes Zeichen nach dem Element.
-
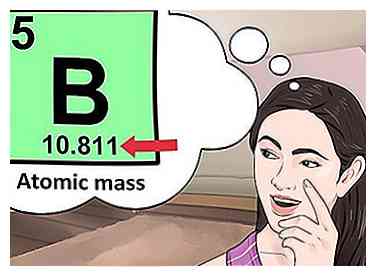 5 Suchen Sie nach der atomaren Masse des Elements. Um die Anzahl der Neutronen zu finden, müssen Sie zuerst die atomare Masse finden. Die Atommasse eines Elements (auch als Atomgewicht bezeichnet) ist die gewichtete durchschnittliche Masse von Atomen eines Elements.[4] Die atomare Masse befindet sich unterhalb des Symbols für das Element.
5 Suchen Sie nach der atomaren Masse des Elements. Um die Anzahl der Neutronen zu finden, müssen Sie zuerst die atomare Masse finden. Die Atommasse eines Elements (auch als Atomgewicht bezeichnet) ist die gewichtete durchschnittliche Masse von Atomen eines Elements.[4] Die atomare Masse befindet sich unterhalb des Symbols für das Element. - Stellen Sie sicher, dass Sie die Atommasse auf die nächste ganze Zahl runden. Zum Beispiel ist die Atommasse von Bor 10.811, aber Sie können gerade die Atommasse bis 11 runden.
-
 6 Subtrahiere die Ordnungszahl von der Atommasse. Um die Anzahl der Neutronen zu finden, müssen Sie die Ordnungszahl von der atomaren Masse abziehen. Denken Sie daran, dass die Ordnungszahl die gleiche ist wie die Anzahl der Protonen, die Sie bereits identifiziert haben.[5]
6 Subtrahiere die Ordnungszahl von der Atommasse. Um die Anzahl der Neutronen zu finden, müssen Sie die Ordnungszahl von der atomaren Masse abziehen. Denken Sie daran, dass die Ordnungszahl die gleiche ist wie die Anzahl der Protonen, die Sie bereits identifiziert haben.[5] - Für unser Borbeispiel 11 (Atommasse) - 5 (Atomzahl) = 6 Neutronen
Teil zwei von zwei:
Berechnen der Elektronen mit vorhandenen Ionen
-
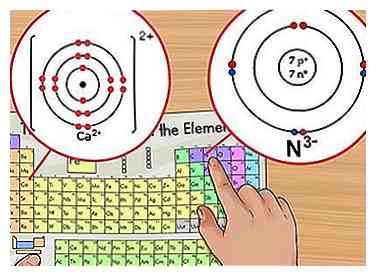 1 Identifizieren Sie die Nettoladung. Die Nettoladung eines Ions erscheint als kleine hochgestellte Zahl nach dem Element. Ein Ion ist ein Atom, das aufgrund des Hinzufügens oder Entfernens von Elektronen positiv oder negativ geladen ist.[6] Obwohl die Anzahl der Protonen im Atom gleich bleibt, ändert sich die Anzahl der Elektronen in einem Ion.
1 Identifizieren Sie die Nettoladung. Die Nettoladung eines Ions erscheint als kleine hochgestellte Zahl nach dem Element. Ein Ion ist ein Atom, das aufgrund des Hinzufügens oder Entfernens von Elektronen positiv oder negativ geladen ist.[6] Obwohl die Anzahl der Protonen im Atom gleich bleibt, ändert sich die Anzahl der Elektronen in einem Ion. - Da ein Elektron eine negative Ladung hat, wird das Ion beim Entfernen von Elektronen positiv. Wenn Sie mehr Elektronen hinzufügen, wird das Ion negativ.
- Zum Beispiel, N3- hat eine -3 Ladung während Ca2+ hat eine Gebühr von +2.
- Beachten Sie, dass Sie diese Berechnung nicht durchführen müssen, wenn nach dem Element keine hochgestellte Ionennummer vorhanden ist.
-
 2 Subtrahiere die Ladung von der Ordnungszahl. Wenn ein Ion eine positive Ladung hat, hat das Atom Elektronen verloren. Um die verbleibende Anzahl von Elektronen zu berechnen, subtrahieren Sie die Menge der zusätzlichen Ladung von der Ordnungszahl. Im Fall eines positiven Ions gibt es mehr Protonen als Elektronen.
2 Subtrahiere die Ladung von der Ordnungszahl. Wenn ein Ion eine positive Ladung hat, hat das Atom Elektronen verloren. Um die verbleibende Anzahl von Elektronen zu berechnen, subtrahieren Sie die Menge der zusätzlichen Ladung von der Ordnungszahl. Im Fall eines positiven Ions gibt es mehr Protonen als Elektronen. - Zum Beispiel Ca2+ hat eine +2 Ladung, also hat es 2 Elektronen aus dem neutralen Zustand verloren. Die Ordnungszahl von Kalzium ist 20, daher hat das Ion 18 Elektronen.
-
 3 Fügen Sie die Ladung der Ordnungszahl für negative Ionen hinzu. Wenn ein Ion eine negative Ladung hat, hat das Atom Elektronen gewonnen. Um die Gesamtzahl der vorhandenen Elektronen zu berechnen, addieren Sie einfach die Menge der zusätzlichen Ladung zu der Ordnungszahl. Im Falle eines negativen Ions gibt es weniger Protonen als Elektronen.
3 Fügen Sie die Ladung der Ordnungszahl für negative Ionen hinzu. Wenn ein Ion eine negative Ladung hat, hat das Atom Elektronen gewonnen. Um die Gesamtzahl der vorhandenen Elektronen zu berechnen, addieren Sie einfach die Menge der zusätzlichen Ladung zu der Ordnungszahl. Im Falle eines negativen Ions gibt es weniger Protonen als Elektronen. - Zum Beispiel, N3- hat eine -3 Ladung; Daher hat es 3 Elektronen im Vergleich zum neutralen Zustand gewonnen. Die Ordnungszahl des Stickstoffs ist 7, daher hat dieses Ion 10 Elektronen.
Facebook
Twitter
Google+
 Minotauromaquia
Minotauromaquia
 1 Holen Sie sich ein Periodensystem von Elementen. Das Periodensystem ist ein Diagramm, das Elemente nach ihrer atomaren Struktur organisiert. Es ist farbcodiert und weist jedem Element eine ein- oder zweistellige Abkürzung zu. Andere Elementarinformationen umfassen das Atomgewicht und die Ordnungszahl.[1]
1 Holen Sie sich ein Periodensystem von Elementen. Das Periodensystem ist ein Diagramm, das Elemente nach ihrer atomaren Struktur organisiert. Es ist farbcodiert und weist jedem Element eine ein- oder zweistellige Abkürzung zu. Andere Elementarinformationen umfassen das Atomgewicht und die Ordnungszahl.[1]  2 Finden Sie Ihr Element im Periodensystem. Die Tabelle ordnet die Elemente nach ihrer Ordnungszahl an und unterteilt sie in drei Hauptgruppen: Metalle, Nichtmetalle und Halbmetalle (Halbmetalle). Weitere elementare Gruppierungen umfassen Alkalimetalle, Halogene und Edelgase.[2]
2 Finden Sie Ihr Element im Periodensystem. Die Tabelle ordnet die Elemente nach ihrer Ordnungszahl an und unterteilt sie in drei Hauptgruppen: Metalle, Nichtmetalle und Halbmetalle (Halbmetalle). Weitere elementare Gruppierungen umfassen Alkalimetalle, Halogene und Edelgase.[2]  3 Suchen Sie die Ordnungszahl des Elements. Die Ordnungszahl befindet sich oberhalb des Elementsymbols in der oberen linken Ecke des Quadrats. Die Ordnungszahl sagt Ihnen, wie viele Protonen ein einzelnes Atom eines Elements ausmachen.[3]
3 Suchen Sie die Ordnungszahl des Elements. Die Ordnungszahl befindet sich oberhalb des Elementsymbols in der oberen linken Ecke des Quadrats. Die Ordnungszahl sagt Ihnen, wie viele Protonen ein einzelnes Atom eines Elements ausmachen.[3]  4 Bestimmen Sie die Anzahl der Elektronen. Protonen sind Teilchen im Kern eines Atoms, die eine positive Ladung von +1 haben. Elektronen sind Teilchen, die eine negative Ladung von -1 haben. Daher wird ein Element in einem neutralen Zustand die gleiche Anzahl von Protonen und Elektronen haben.
4 Bestimmen Sie die Anzahl der Elektronen. Protonen sind Teilchen im Kern eines Atoms, die eine positive Ladung von +1 haben. Elektronen sind Teilchen, die eine negative Ladung von -1 haben. Daher wird ein Element in einem neutralen Zustand die gleiche Anzahl von Protonen und Elektronen haben. 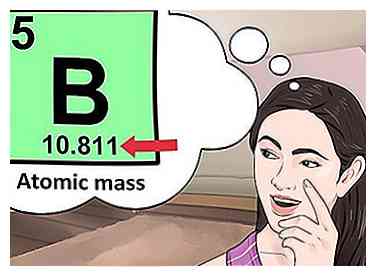 5 Suchen Sie nach der atomaren Masse des Elements. Um die Anzahl der Neutronen zu finden, müssen Sie zuerst die atomare Masse finden. Die Atommasse eines Elements (auch als Atomgewicht bezeichnet) ist die gewichtete durchschnittliche Masse von Atomen eines Elements.[4] Die atomare Masse befindet sich unterhalb des Symbols für das Element.
5 Suchen Sie nach der atomaren Masse des Elements. Um die Anzahl der Neutronen zu finden, müssen Sie zuerst die atomare Masse finden. Die Atommasse eines Elements (auch als Atomgewicht bezeichnet) ist die gewichtete durchschnittliche Masse von Atomen eines Elements.[4] Die atomare Masse befindet sich unterhalb des Symbols für das Element.  6 Subtrahiere die Ordnungszahl von der Atommasse. Um die Anzahl der Neutronen zu finden, müssen Sie die Ordnungszahl von der atomaren Masse abziehen. Denken Sie daran, dass die Ordnungszahl die gleiche ist wie die Anzahl der Protonen, die Sie bereits identifiziert haben.[5]
6 Subtrahiere die Ordnungszahl von der Atommasse. Um die Anzahl der Neutronen zu finden, müssen Sie die Ordnungszahl von der atomaren Masse abziehen. Denken Sie daran, dass die Ordnungszahl die gleiche ist wie die Anzahl der Protonen, die Sie bereits identifiziert haben.[5]  1 Identifizieren Sie die Nettoladung. Die Nettoladung eines Ions erscheint als kleine hochgestellte Zahl nach dem Element. Ein Ion ist ein Atom, das aufgrund des Hinzufügens oder Entfernens von Elektronen positiv oder negativ geladen ist.[6] Obwohl die Anzahl der Protonen im Atom gleich bleibt, ändert sich die Anzahl der Elektronen in einem Ion.
1 Identifizieren Sie die Nettoladung. Die Nettoladung eines Ions erscheint als kleine hochgestellte Zahl nach dem Element. Ein Ion ist ein Atom, das aufgrund des Hinzufügens oder Entfernens von Elektronen positiv oder negativ geladen ist.[6] Obwohl die Anzahl der Protonen im Atom gleich bleibt, ändert sich die Anzahl der Elektronen in einem Ion.  2 Subtrahiere die Ladung von der Ordnungszahl. Wenn ein Ion eine positive Ladung hat, hat das Atom Elektronen verloren. Um die verbleibende Anzahl von Elektronen zu berechnen, subtrahieren Sie die Menge der zusätzlichen Ladung von der Ordnungszahl. Im Fall eines positiven Ions gibt es mehr Protonen als Elektronen.
2 Subtrahiere die Ladung von der Ordnungszahl. Wenn ein Ion eine positive Ladung hat, hat das Atom Elektronen verloren. Um die verbleibende Anzahl von Elektronen zu berechnen, subtrahieren Sie die Menge der zusätzlichen Ladung von der Ordnungszahl. Im Fall eines positiven Ions gibt es mehr Protonen als Elektronen.  3 Fügen Sie die Ladung der Ordnungszahl für negative Ionen hinzu. Wenn ein Ion eine negative Ladung hat, hat das Atom Elektronen gewonnen. Um die Gesamtzahl der vorhandenen Elektronen zu berechnen, addieren Sie einfach die Menge der zusätzlichen Ladung zu der Ordnungszahl. Im Falle eines negativen Ions gibt es weniger Protonen als Elektronen.
3 Fügen Sie die Ladung der Ordnungszahl für negative Ionen hinzu. Wenn ein Ion eine negative Ladung hat, hat das Atom Elektronen gewonnen. Um die Gesamtzahl der vorhandenen Elektronen zu berechnen, addieren Sie einfach die Menge der zusätzlichen Ladung zu der Ordnungszahl. Im Falle eines negativen Ions gibt es weniger Protonen als Elektronen.