In Chemie, Valenzelektronen sind die Elektronen, die sich in der äußersten Elektronenhülle eines Elements befinden. Zu wissen, wie man die Anzahl der Valenzelektronen in einem bestimmten Atom findet, ist eine wichtige Fähigkeit für Chemiker, da diese Information die Arten von chemischen Bindungen, die es bilden kann, und daher die Reaktivität des Elements bestimmt. Glücklicherweise ist alles, was Sie brauchen, um die Valenzelektronen eines Elements zu finden, ein Standardperiodensystem der Elemente.
Teil eins von zwei:
Valenzelektronen mit einem Periodensystem finden
Nicht-Übergangsmetalle
-
 1 Finde ein Periodensystem von Elementen. Dies ist eine farbcodierte Tabelle, die aus vielen verschiedenen Quadraten besteht, die alle chemischen Elemente auflistet, die der Menschheit bekannt sind. Das Periodensystem zeigt viele Informationen über die Elemente an - wir werden einige dieser Informationen verwenden, um die Anzahl der Valenzelektronen in dem Atom, das wir untersuchen, zu bestimmen. Sie können diese normalerweise innerhalb des Deckels der Chemielehrbücher finden. Es gibt auch einen ausgezeichneten interaktiven Tisch hier online.[1]
1 Finde ein Periodensystem von Elementen. Dies ist eine farbcodierte Tabelle, die aus vielen verschiedenen Quadraten besteht, die alle chemischen Elemente auflistet, die der Menschheit bekannt sind. Das Periodensystem zeigt viele Informationen über die Elemente an - wir werden einige dieser Informationen verwenden, um die Anzahl der Valenzelektronen in dem Atom, das wir untersuchen, zu bestimmen. Sie können diese normalerweise innerhalb des Deckels der Chemielehrbücher finden. Es gibt auch einen ausgezeichneten interaktiven Tisch hier online.[1] -
 2 Beschriften Sie jede Spalte im Periodensystem der Elemente von 1 bis 18. Im Allgemeinen haben alle Elemente in einer einzelnen vertikalen Spalte in einem Periodensystem die gleiche Anzahl von Valenzelektronen. Wenn in Ihrem Periodensystem nicht bereits jede Spalte nummeriert ist, geben Sie jedem eine Zahl beginnend mit 1 für das äußerste linke Ende und 18 für das äußerste rechte Ende. In wissenschaftlicher Hinsicht heißen diese Spalten das Element "Gruppen."[2]
2 Beschriften Sie jede Spalte im Periodensystem der Elemente von 1 bis 18. Im Allgemeinen haben alle Elemente in einer einzelnen vertikalen Spalte in einem Periodensystem die gleiche Anzahl von Valenzelektronen. Wenn in Ihrem Periodensystem nicht bereits jede Spalte nummeriert ist, geben Sie jedem eine Zahl beginnend mit 1 für das äußerste linke Ende und 18 für das äußerste rechte Ende. In wissenschaftlicher Hinsicht heißen diese Spalten das Element "Gruppen."[2] - Wenn wir zum Beispiel mit einem Periodensystem arbeiten, in dem die Gruppen nicht nummeriert sind, schreiben wir eine 1 über Wasserstoff (H), eine 2 über Beryllium (Be) und so weiter, bis wir eine 18 über Helium (He) schreiben. .
-
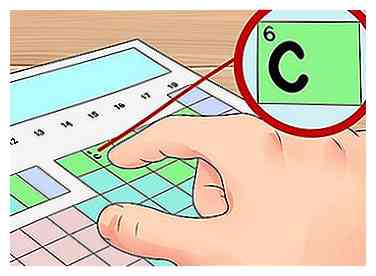 3 Finde dein Element auf dem Tisch. Suchen Sie nun nach dem Element, nach dem Sie die Valenzelektronen auf dem Tisch suchen möchten. Sie können dies mit seinem chemischen Symbol (die Buchstaben in jedem Feld), seiner Ordnungszahl (die Zahl in der oberen linken Ecke jeder Box) oder den anderen Informationen, die Ihnen auf dem Tisch zur Verfügung stehen, machen.
3 Finde dein Element auf dem Tisch. Suchen Sie nun nach dem Element, nach dem Sie die Valenzelektronen auf dem Tisch suchen möchten. Sie können dies mit seinem chemischen Symbol (die Buchstaben in jedem Feld), seiner Ordnungszahl (die Zahl in der oberen linken Ecke jeder Box) oder den anderen Informationen, die Ihnen auf dem Tisch zur Verfügung stehen, machen. - Zum Beispiel finden wir die Valenzelektronen für ein sehr häufiges Element: Kohlenstoff (C). Dieses Element hat eine Ordnungszahl von 6. Es befindet sich an der Spitze der Gruppe 14. Im nächsten Schritt finden wir seine Valenzelektronen.
- In diesem Unterabschnitt werden wir die Übergangsmetalle ignorieren, die die Elemente in dem rechteckigen Block der Gruppen 3 bis 12 sind. Diese Elemente unterscheiden sich ein wenig von den anderen, so dass die Schritte in diesem Unterabschnitt gewonnen haben. t arbeiten an ihnen. Sehen Sie, wie Sie mit diesen im folgenden Unterabschnitt umgehen.
-
 4 Verwenden Sie die Gruppennummern, um die Anzahl der Valenzelektronen zu bestimmen. Die Gruppennummer eines Nicht-Übergangsmetalls kann verwendet werden, um die Anzahl von Valenzelektronen in einem Atom dieses Elements zu finden. Das ein Ort der Gruppennummer ist die Anzahl der Valenzelektronen in einem Atom dieser Elemente. Mit anderen Worten:
4 Verwenden Sie die Gruppennummern, um die Anzahl der Valenzelektronen zu bestimmen. Die Gruppennummer eines Nicht-Übergangsmetalls kann verwendet werden, um die Anzahl von Valenzelektronen in einem Atom dieses Elements zu finden. Das ein Ort der Gruppennummer ist die Anzahl der Valenzelektronen in einem Atom dieser Elemente. Mit anderen Worten: - Gruppe 1: 1 Valenzelektron
- Gruppe 2: 2 Valenzelektronen
- Gruppe 13: 3 Valenzelektronen
- Gruppe 14: 4 Valenzelektronen
- Gruppe 15: 5 Valenzelektronen
- Gruppe 16: 6 Valenzelektronen
- Gruppe 17: 7 Valenzelektronen
- Gruppe 18: 8 Valenzelektronen (außer Helium, das 2 hat)
- Da in unserem Beispiel Kohlenstoff in Gruppe 14 ist, können wir sagen, dass ein Atom Kohlenstoff hat vier Valenzelektronen.
Übergangsmetalle
-
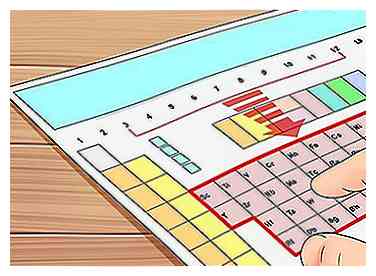 1 Suchen Sie ein Element aus den Gruppen 3 bis 12. Wie oben erwähnt, werden die Elemente in den Gruppen 3 bis 12 "Übergangsmetalle" genannt und verhalten sich anders als der Rest der Elemente, wenn es sich um Valenzelektronen handelt. In diesem Abschnitt erklären wir, wie es oft nicht möglich ist, diesen Atomen Valenzelektronen zuzuordnen.
1 Suchen Sie ein Element aus den Gruppen 3 bis 12. Wie oben erwähnt, werden die Elemente in den Gruppen 3 bis 12 "Übergangsmetalle" genannt und verhalten sich anders als der Rest der Elemente, wenn es sich um Valenzelektronen handelt. In diesem Abschnitt erklären wir, wie es oft nicht möglich ist, diesen Atomen Valenzelektronen zuzuordnen. - Zum Beispiel wählen wir Tantal (Ta), Element 73. In den nächsten Schritten finden wir seine Valenzelektronen (oder zumindest Versuchen zu.)
- Beachten Sie, dass die Übergangsmetalle die Lanthaniden- und Actinidenreihe (auch "Seltenerdmetalle" genannt) umfassen - die zwei Reihen von Elementen, die üblicherweise unter dem Rest der Tabelle positioniert sind und mit Lanthan und Aktinium beginnen. Diese Elemente gehören alle dazu Gruppe 3 des Periodensystems.
-
 2 Verstehen Sie, dass Übergangsmetalle keine "traditionellen" Valenzelektronen haben. Zu verstehen, warum Übergangsmetalle nicht wie der Rest des Periodensystems wirklich "funktionieren", erfordert eine kleine Erklärung dafür, wie sich Elektronen in Atomen verhalten. Siehe unten für einen kurzen Durchlauf oder überspringen Sie diesen Schritt, um direkt zu den Antworten zu gelangen.[3]
2 Verstehen Sie, dass Übergangsmetalle keine "traditionellen" Valenzelektronen haben. Zu verstehen, warum Übergangsmetalle nicht wie der Rest des Periodensystems wirklich "funktionieren", erfordert eine kleine Erklärung dafür, wie sich Elektronen in Atomen verhalten. Siehe unten für einen kurzen Durchlauf oder überspringen Sie diesen Schritt, um direkt zu den Antworten zu gelangen.[3] - Wenn Elektronen einem Atom hinzugefügt werden, werden sie in verschiedene "Orbitale" sortiert - im Grunde verschiedene Bereiche um den Kern herum, in dem sich die Elektronen ansammeln. Im Allgemeinen sind die Valenzelektronen die Elektronen in der äußersten Schale - mit anderen Worten die letzten hinzugefügten Elektronen .
- Aus Gründen, die hier etwas zu komplex sind, wenn Elektronen zu den äußersten hinzugefügt werden d Englisch: elib.uni-stuttgart.de/opus/frontdoo...rce_opus = 732 Die ersten Elektronen, die in die Schale gehen, verhalten sich wie normale Valenzelektronen, aber danach nicht mehr, und Elektronen aus anderen Orbitalschichten wirken manchmal als Valenzelektronen. Dies bedeutet, dass ein Atom mehrere Zahlen von Valenzelektronen haben kann, abhängig davon, wie es manipuliert wird.
- Für eine detailliertere Erklärung, siehe die ausgezeichnete Valenzelektronen-Seite des Clackamas Community College.[4]
-
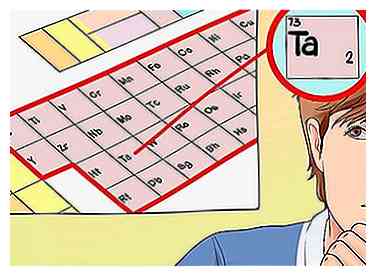 3 Bestimmen Sie die Anzahl der Valenzelektronen anhand der Gruppennummer. Wiederum kann Ihnen die Gruppennummer des Elements, das Sie untersuchen, seine Valenzelektronen mitteilen. Für die Übergangsmetalle gibt es jedoch kein Muster, dem Sie folgen können - die Gruppennummer entspricht normalerweise einer Reihe möglicher Valenzelektronen.Diese sind:[5]
3 Bestimmen Sie die Anzahl der Valenzelektronen anhand der Gruppennummer. Wiederum kann Ihnen die Gruppennummer des Elements, das Sie untersuchen, seine Valenzelektronen mitteilen. Für die Übergangsmetalle gibt es jedoch kein Muster, dem Sie folgen können - die Gruppennummer entspricht normalerweise einer Reihe möglicher Valenzelektronen.Diese sind:[5] - Gruppe 3: 3 Valenzelektronen
- Gruppe 4: 2 bis 4 Valenzelektronen
- Gruppe 5: 2 bis 5 Valenzelektronen
- Gruppe 6: 2 bis 6 Valenzelektronen
- Gruppe 7: 2 bis 7 Valenzelektronen
- Gruppe 8: 2 oder 3 Valenzelektronen
- Gruppe 9: 2 oder 3 Valenzelektronen
- Gruppe 10: 2 oder 3 Valenzelektronen
- Gruppe 11: 1 oder 2 Valenzelektronen
- Gruppe 12: 2 Valenzelektronen
- Da in unserem Beispiel Tantal in Gruppe 5 ist, können wir sagen, dass es dazwischen ist zwei und fünf Valenzelektronen, kommt auf die Situation an.
Teil zwei von zwei:
Valenzelektronen mit einer Elektronenkonfiguration finden
-
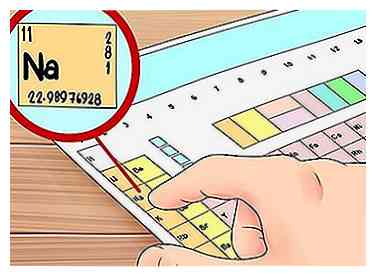 1 Lerne, wie man eine Elektronenkonfiguration liest. Eine andere Möglichkeit, die Valenzelektronen eines Elements zu finden, ist eine Elektronenkonfiguration. Diese können auf den ersten Blick kompliziert aussehen, aber sie sind nur eine Möglichkeit, die Elektronenorbitale in einem Atom mit Buchstaben und Zahlen darzustellen, und sie sind einfach, wenn Sie wissen, was Sie sehen.
1 Lerne, wie man eine Elektronenkonfiguration liest. Eine andere Möglichkeit, die Valenzelektronen eines Elements zu finden, ist eine Elektronenkonfiguration. Diese können auf den ersten Blick kompliziert aussehen, aber sie sind nur eine Möglichkeit, die Elektronenorbitale in einem Atom mit Buchstaben und Zahlen darzustellen, und sie sind einfach, wenn Sie wissen, was Sie sehen. - Schauen wir uns eine Beispielkonfiguration für das Element Natrium (Na) an:
-
- 1s22s22p63s1
-
- Beachten Sie, dass diese Elektronenkonfiguration nur eine sich wiederholende Zeichenfolge ist, die folgendermaßen lautet:
-
- (Nummer) (Buchstabe)(angehobene Zahl)(Nummer) (Buchstabe)(angehobene Zahl)…
-
- … und so weiter. Das (Nummer) (Buchstabe) Brocken ist der Name des Elektronenorbitals und der (angehobene Zahl) ist die Anzahl der Elektronen in diesem Orbital - das ist es!
- Also, für unser Beispiel würden wir sagen, dass Natrium hat 2 Elektronen im 1s-Orbital Plus 2 Elektronen im 2s-Orbital Plus 6 Elektronen im 2p-Orbital Plus 1 Elektron im 3s-Orbital. Das sind 11 Elektronen insgesamt - Natrium ist Element Nummer 11, also macht das Sinn.
- Bedenken Sie, dass jede Unterschale eine bestimmte Elektronenkapazität hat. Ihre Elektronenkapazitäten sind wie folgt:
- s: 2 Elektronen Kapazität
- p: 6 Elektronenkapazität
- d: 10 Elektronenkapazität
- f: 14 Elektronenkapazität
- Schauen wir uns eine Beispielkonfiguration für das Element Natrium (Na) an:
-
 2 Suchen Sie die Elektronenkonfiguration für das Element, das Sie untersuchen. Sobald Sie die Elektronenkonfiguration eines Elements kennen, ist es ganz einfach, die Anzahl der Valenzelektronen zu finden (außer natürlich für die Übergangsmetalle.) Wenn Sie die Konfiguration von Anfang an erhalten, können Sie zum nächsten Schritt übergehen. Wenn Sie es selbst finden müssen, siehe unten:
2 Suchen Sie die Elektronenkonfiguration für das Element, das Sie untersuchen. Sobald Sie die Elektronenkonfiguration eines Elements kennen, ist es ganz einfach, die Anzahl der Valenzelektronen zu finden (außer natürlich für die Übergangsmetalle.) Wenn Sie die Konfiguration von Anfang an erhalten, können Sie zum nächsten Schritt übergehen. Wenn Sie es selbst finden müssen, siehe unten: - Untersuchen Sie die vollständige Elektronenkonfiguration für ognesson (Og), Element 118, welches das letzte Element des Periodensystems ist. Es hat die meisten Elektronen eines Elements, daher zeigt seine Elektronenkonfiguration alle Möglichkeiten, die Sie in anderen Elementen finden könnten:
-
- 1s22s22p63s23p64s23d104p65s24d105p66s24f145d106p67s25f146d107p6
-
- Nun, da Sie dies haben, müssen Sie nur noch dieses Muster von Anfang an ausfüllen, bis Sie keine Elektronen mehr haben. Das ist einfacher als es klingt. Wenn wir zum Beispiel das Orbitaldiagramm für Chlor (Cl), Element 17, das 17 Elektronen hat, machen wollen, würden wir es so machen:
-
- 1s22s22p63s23p5
-
- Beachten Sie, dass die Anzahl der Elektronen zu 17: 2 + 2 + 6 + 2 + 5 = 17 addiert. Sie müssen nur die Zahl im letzten Orbital ändern - der Rest ist der gleiche, da die Orbitale vor dem letzten vollständig gefüllt sind .
- Weitere Informationen zu Elektronenkonfigurationen finden Sie in diesem Artikel.
- Untersuchen Sie die vollständige Elektronenkonfiguration für ognesson (Og), Element 118, welches das letzte Element des Periodensystems ist. Es hat die meisten Elektronen eines Elements, daher zeigt seine Elektronenkonfiguration alle Möglichkeiten, die Sie in anderen Elementen finden könnten:
-
 3 Ordnen Sie den Orbitalschalen mit der Oktettregel Elektronen zu. Wenn Elektronen zu einem Atom hinzugefügt werden, fallen sie in verschiedene Orbitale in der oben angegebenen Reihenfolge - die ersten beiden gehen in das 1s - Orbital, die zwei danach in das 2s - Orbital, die sechs danach in das 2p - Orbital, und bald. Wenn wir uns mit Atomen außerhalb der Übergangsmetalle beschäftigen, sagen wir, dass diese Orbitale "Orbitalschalen" um den Kern bilden, wobei jede nachfolgende Schale weiter außen liegt als die vorherigen. Neben der allerersten Schale, die nur zwei Elektronen aufnehmen kann, kann jede Schale acht Elektronen haben (außer bei Übergangsmetallen) Oktettregel.
3 Ordnen Sie den Orbitalschalen mit der Oktettregel Elektronen zu. Wenn Elektronen zu einem Atom hinzugefügt werden, fallen sie in verschiedene Orbitale in der oben angegebenen Reihenfolge - die ersten beiden gehen in das 1s - Orbital, die zwei danach in das 2s - Orbital, die sechs danach in das 2p - Orbital, und bald. Wenn wir uns mit Atomen außerhalb der Übergangsmetalle beschäftigen, sagen wir, dass diese Orbitale "Orbitalschalen" um den Kern bilden, wobei jede nachfolgende Schale weiter außen liegt als die vorherigen. Neben der allerersten Schale, die nur zwei Elektronen aufnehmen kann, kann jede Schale acht Elektronen haben (außer bei Übergangsmetallen) Oktettregel. - Betrachten wir zum Beispiel das Element Bor (B). Da seine Ordnungszahl fünf ist, wissen wir, dass es fünf Elektronen hat und seine Elektronenkonfiguration wie folgt aussieht: 1s22s22p1. Da die erste Orbitalschale nur zwei Elektronen hat, wissen wir, dass Bor zwei Schalen hat: eine mit zwei 1s Elektronen und eine mit drei Elektronen aus den 2s und 2p Orbitalen.
- Ein anderes Beispiel ist ein Element wie Chlor (1s22s22p63s23p5) wird drei Orbitalschalen haben: eine mit zwei 1s Elektronen, eine mit zwei 2s Elektronen und sechs 2p Elektronen, und eine mit zwei 3s Elektronen und fünf 3p Elektronen.
-
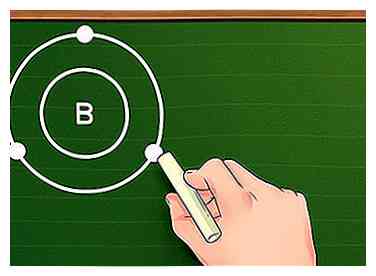 4 Finde die Anzahl der Elektronen in der äußersten Schale. Jetzt, da Sie die Elektronenschalen Ihres Elements kennen, ist es einfach, die Valenzelektronen zu finden: Verwenden Sie einfach die Anzahl der Elektronen in der äußersten Schale. Wenn die äußere Hülle voll ist (mit anderen Worten, wenn sie acht Elektronen hat oder, für die erste Hülle, zwei), ist das Element inert und reagiert nicht leicht mit anderen Elementen. Wiederum folgen diese Regeln für Übergangsmetalle nicht ganz.
4 Finde die Anzahl der Elektronen in der äußersten Schale. Jetzt, da Sie die Elektronenschalen Ihres Elements kennen, ist es einfach, die Valenzelektronen zu finden: Verwenden Sie einfach die Anzahl der Elektronen in der äußersten Schale. Wenn die äußere Hülle voll ist (mit anderen Worten, wenn sie acht Elektronen hat oder, für die erste Hülle, zwei), ist das Element inert und reagiert nicht leicht mit anderen Elementen. Wiederum folgen diese Regeln für Übergangsmetalle nicht ganz. - Wenn wir zum Beispiel mit Bor arbeiten, können wir sagen, dass Bor drei Elektronen in der zweiten Schale hat drei Valenzelektronen.
-
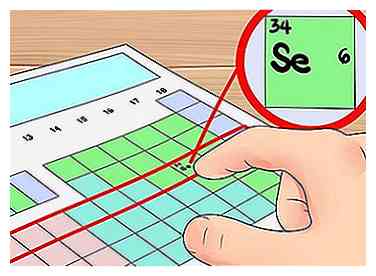 5 Verwenden Sie die Zeilen der Tabelle als Shortcuts für die Orbitalshell. Die horizontalen Zeilen des Periodensystems werden Element genannt "Perioden." Ausgehend von der Spitze der Tabelle entspricht jede Periode der Anzahl von Elektronenschalen die Atome in der Periode besitzen.Sie können dies als Abkürzung verwenden, um zu bestimmen, wie viele Valenzelektronen ein Element hat - starten Sie einfach von der linken Seite seiner Periode, wenn Sie Elektronen zählen. Noch einmal, Sie wollen die Übergangsmetalle mit dieser Methode ignorieren, die Gruppen 3-12 enthält.
5 Verwenden Sie die Zeilen der Tabelle als Shortcuts für die Orbitalshell. Die horizontalen Zeilen des Periodensystems werden Element genannt "Perioden." Ausgehend von der Spitze der Tabelle entspricht jede Periode der Anzahl von Elektronenschalen die Atome in der Periode besitzen.Sie können dies als Abkürzung verwenden, um zu bestimmen, wie viele Valenzelektronen ein Element hat - starten Sie einfach von der linken Seite seiner Periode, wenn Sie Elektronen zählen. Noch einmal, Sie wollen die Übergangsmetalle mit dieser Methode ignorieren, die Gruppen 3-12 enthält. - Zum Beispiel wissen wir, dass das Element Selen vier Orbitalschalen hat, weil es in der vierten Periode ist. Da es das sechste Element von links in der vierten Periode ist (die Übergangsmetalle ignorierend), wissen wir, dass die äußere vierte Schale sechs Elektronen hat und somit Selen hat sechs Valenzelektronen.
Facebook
Twitter
Google+
 Minotauromaquia
Minotauromaquia
 1 Finde ein Periodensystem von Elementen. Dies ist eine farbcodierte Tabelle, die aus vielen verschiedenen Quadraten besteht, die alle chemischen Elemente auflistet, die der Menschheit bekannt sind. Das Periodensystem zeigt viele Informationen über die Elemente an - wir werden einige dieser Informationen verwenden, um die Anzahl der Valenzelektronen in dem Atom, das wir untersuchen, zu bestimmen. Sie können diese normalerweise innerhalb des Deckels der Chemielehrbücher finden. Es gibt auch einen ausgezeichneten interaktiven Tisch hier online.[1]
1 Finde ein Periodensystem von Elementen. Dies ist eine farbcodierte Tabelle, die aus vielen verschiedenen Quadraten besteht, die alle chemischen Elemente auflistet, die der Menschheit bekannt sind. Das Periodensystem zeigt viele Informationen über die Elemente an - wir werden einige dieser Informationen verwenden, um die Anzahl der Valenzelektronen in dem Atom, das wir untersuchen, zu bestimmen. Sie können diese normalerweise innerhalb des Deckels der Chemielehrbücher finden. Es gibt auch einen ausgezeichneten interaktiven Tisch hier online.[1]  2 Beschriften Sie jede Spalte im Periodensystem der Elemente von 1 bis 18. Im Allgemeinen haben alle Elemente in einer einzelnen vertikalen Spalte in einem Periodensystem die gleiche Anzahl von Valenzelektronen. Wenn in Ihrem Periodensystem nicht bereits jede Spalte nummeriert ist, geben Sie jedem eine Zahl beginnend mit 1 für das äußerste linke Ende und 18 für das äußerste rechte Ende. In wissenschaftlicher Hinsicht heißen diese Spalten das Element "Gruppen."[2]
2 Beschriften Sie jede Spalte im Periodensystem der Elemente von 1 bis 18. Im Allgemeinen haben alle Elemente in einer einzelnen vertikalen Spalte in einem Periodensystem die gleiche Anzahl von Valenzelektronen. Wenn in Ihrem Periodensystem nicht bereits jede Spalte nummeriert ist, geben Sie jedem eine Zahl beginnend mit 1 für das äußerste linke Ende und 18 für das äußerste rechte Ende. In wissenschaftlicher Hinsicht heißen diese Spalten das Element "Gruppen."[2]  3 Finde dein Element auf dem Tisch. Suchen Sie nun nach dem Element, nach dem Sie die Valenzelektronen auf dem Tisch suchen möchten. Sie können dies mit seinem chemischen Symbol (die Buchstaben in jedem Feld), seiner Ordnungszahl (die Zahl in der oberen linken Ecke jeder Box) oder den anderen Informationen, die Ihnen auf dem Tisch zur Verfügung stehen, machen.
3 Finde dein Element auf dem Tisch. Suchen Sie nun nach dem Element, nach dem Sie die Valenzelektronen auf dem Tisch suchen möchten. Sie können dies mit seinem chemischen Symbol (die Buchstaben in jedem Feld), seiner Ordnungszahl (die Zahl in der oberen linken Ecke jeder Box) oder den anderen Informationen, die Ihnen auf dem Tisch zur Verfügung stehen, machen.  4 Verwenden Sie die Gruppennummern, um die Anzahl der Valenzelektronen zu bestimmen. Die Gruppennummer eines Nicht-Übergangsmetalls kann verwendet werden, um die Anzahl von Valenzelektronen in einem Atom dieses Elements zu finden. Das ein Ort der Gruppennummer ist die Anzahl der Valenzelektronen in einem Atom dieser Elemente. Mit anderen Worten:
4 Verwenden Sie die Gruppennummern, um die Anzahl der Valenzelektronen zu bestimmen. Die Gruppennummer eines Nicht-Übergangsmetalls kann verwendet werden, um die Anzahl von Valenzelektronen in einem Atom dieses Elements zu finden. Das ein Ort der Gruppennummer ist die Anzahl der Valenzelektronen in einem Atom dieser Elemente. Mit anderen Worten:  1 Suchen Sie ein Element aus den Gruppen 3 bis 12. Wie oben erwähnt, werden die Elemente in den Gruppen 3 bis 12 "Übergangsmetalle" genannt und verhalten sich anders als der Rest der Elemente, wenn es sich um Valenzelektronen handelt. In diesem Abschnitt erklären wir, wie es oft nicht möglich ist, diesen Atomen Valenzelektronen zuzuordnen.
1 Suchen Sie ein Element aus den Gruppen 3 bis 12. Wie oben erwähnt, werden die Elemente in den Gruppen 3 bis 12 "Übergangsmetalle" genannt und verhalten sich anders als der Rest der Elemente, wenn es sich um Valenzelektronen handelt. In diesem Abschnitt erklären wir, wie es oft nicht möglich ist, diesen Atomen Valenzelektronen zuzuordnen.  2 Verstehen Sie, dass Übergangsmetalle keine "traditionellen" Valenzelektronen haben. Zu verstehen, warum Übergangsmetalle nicht wie der Rest des Periodensystems wirklich "funktionieren", erfordert eine kleine Erklärung dafür, wie sich Elektronen in Atomen verhalten. Siehe unten für einen kurzen Durchlauf oder überspringen Sie diesen Schritt, um direkt zu den Antworten zu gelangen.[3]
2 Verstehen Sie, dass Übergangsmetalle keine "traditionellen" Valenzelektronen haben. Zu verstehen, warum Übergangsmetalle nicht wie der Rest des Periodensystems wirklich "funktionieren", erfordert eine kleine Erklärung dafür, wie sich Elektronen in Atomen verhalten. Siehe unten für einen kurzen Durchlauf oder überspringen Sie diesen Schritt, um direkt zu den Antworten zu gelangen.[3]  3 Bestimmen Sie die Anzahl der Valenzelektronen anhand der Gruppennummer. Wiederum kann Ihnen die Gruppennummer des Elements, das Sie untersuchen, seine Valenzelektronen mitteilen. Für die Übergangsmetalle gibt es jedoch kein Muster, dem Sie folgen können - die Gruppennummer entspricht normalerweise einer Reihe möglicher Valenzelektronen.Diese sind:[5]
3 Bestimmen Sie die Anzahl der Valenzelektronen anhand der Gruppennummer. Wiederum kann Ihnen die Gruppennummer des Elements, das Sie untersuchen, seine Valenzelektronen mitteilen. Für die Übergangsmetalle gibt es jedoch kein Muster, dem Sie folgen können - die Gruppennummer entspricht normalerweise einer Reihe möglicher Valenzelektronen.Diese sind:[5]  1 Lerne, wie man eine Elektronenkonfiguration liest. Eine andere Möglichkeit, die Valenzelektronen eines Elements zu finden, ist eine Elektronenkonfiguration. Diese können auf den ersten Blick kompliziert aussehen, aber sie sind nur eine Möglichkeit, die Elektronenorbitale in einem Atom mit Buchstaben und Zahlen darzustellen, und sie sind einfach, wenn Sie wissen, was Sie sehen.
1 Lerne, wie man eine Elektronenkonfiguration liest. Eine andere Möglichkeit, die Valenzelektronen eines Elements zu finden, ist eine Elektronenkonfiguration. Diese können auf den ersten Blick kompliziert aussehen, aber sie sind nur eine Möglichkeit, die Elektronenorbitale in einem Atom mit Buchstaben und Zahlen darzustellen, und sie sind einfach, wenn Sie wissen, was Sie sehen.  2 Suchen Sie die Elektronenkonfiguration für das Element, das Sie untersuchen. Sobald Sie die Elektronenkonfiguration eines Elements kennen, ist es ganz einfach, die Anzahl der Valenzelektronen zu finden (außer natürlich für die Übergangsmetalle.) Wenn Sie die Konfiguration von Anfang an erhalten, können Sie zum nächsten Schritt übergehen. Wenn Sie es selbst finden müssen, siehe unten:
2 Suchen Sie die Elektronenkonfiguration für das Element, das Sie untersuchen. Sobald Sie die Elektronenkonfiguration eines Elements kennen, ist es ganz einfach, die Anzahl der Valenzelektronen zu finden (außer natürlich für die Übergangsmetalle.) Wenn Sie die Konfiguration von Anfang an erhalten, können Sie zum nächsten Schritt übergehen. Wenn Sie es selbst finden müssen, siehe unten:  3 Ordnen Sie den Orbitalschalen mit der Oktettregel Elektronen zu. Wenn Elektronen zu einem Atom hinzugefügt werden, fallen sie in verschiedene Orbitale in der oben angegebenen Reihenfolge - die ersten beiden gehen in das 1s - Orbital, die zwei danach in das 2s - Orbital, die sechs danach in das 2p - Orbital, und bald. Wenn wir uns mit Atomen außerhalb der Übergangsmetalle beschäftigen, sagen wir, dass diese Orbitale "Orbitalschalen" um den Kern bilden, wobei jede nachfolgende Schale weiter außen liegt als die vorherigen. Neben der allerersten Schale, die nur zwei Elektronen aufnehmen kann, kann jede Schale acht Elektronen haben (außer bei Übergangsmetallen) Oktettregel.
3 Ordnen Sie den Orbitalschalen mit der Oktettregel Elektronen zu. Wenn Elektronen zu einem Atom hinzugefügt werden, fallen sie in verschiedene Orbitale in der oben angegebenen Reihenfolge - die ersten beiden gehen in das 1s - Orbital, die zwei danach in das 2s - Orbital, die sechs danach in das 2p - Orbital, und bald. Wenn wir uns mit Atomen außerhalb der Übergangsmetalle beschäftigen, sagen wir, dass diese Orbitale "Orbitalschalen" um den Kern bilden, wobei jede nachfolgende Schale weiter außen liegt als die vorherigen. Neben der allerersten Schale, die nur zwei Elektronen aufnehmen kann, kann jede Schale acht Elektronen haben (außer bei Übergangsmetallen) Oktettregel.  4 Finde die Anzahl der Elektronen in der äußersten Schale. Jetzt, da Sie die Elektronenschalen Ihres Elements kennen, ist es einfach, die Valenzelektronen zu finden: Verwenden Sie einfach die Anzahl der Elektronen in der äußersten Schale. Wenn die äußere Hülle voll ist (mit anderen Worten, wenn sie acht Elektronen hat oder, für die erste Hülle, zwei), ist das Element inert und reagiert nicht leicht mit anderen Elementen. Wiederum folgen diese Regeln für Übergangsmetalle nicht ganz.
4 Finde die Anzahl der Elektronen in der äußersten Schale. Jetzt, da Sie die Elektronenschalen Ihres Elements kennen, ist es einfach, die Valenzelektronen zu finden: Verwenden Sie einfach die Anzahl der Elektronen in der äußersten Schale. Wenn die äußere Hülle voll ist (mit anderen Worten, wenn sie acht Elektronen hat oder, für die erste Hülle, zwei), ist das Element inert und reagiert nicht leicht mit anderen Elementen. Wiederum folgen diese Regeln für Übergangsmetalle nicht ganz.  5 Verwenden Sie die Zeilen der Tabelle als Shortcuts für die Orbitalshell. Die horizontalen Zeilen des Periodensystems werden Element genannt "Perioden." Ausgehend von der Spitze der Tabelle entspricht jede Periode der Anzahl von Elektronenschalen die Atome in der Periode besitzen.Sie können dies als Abkürzung verwenden, um zu bestimmen, wie viele Valenzelektronen ein Element hat - starten Sie einfach von der linken Seite seiner Periode, wenn Sie Elektronen zählen. Noch einmal, Sie wollen die Übergangsmetalle mit dieser Methode ignorieren, die Gruppen 3-12 enthält.
5 Verwenden Sie die Zeilen der Tabelle als Shortcuts für die Orbitalshell. Die horizontalen Zeilen des Periodensystems werden Element genannt "Perioden." Ausgehend von der Spitze der Tabelle entspricht jede Periode der Anzahl von Elektronenschalen die Atome in der Periode besitzen.Sie können dies als Abkürzung verwenden, um zu bestimmen, wie viele Valenzelektronen ein Element hat - starten Sie einfach von der linken Seite seiner Periode, wenn Sie Elektronen zählen. Noch einmal, Sie wollen die Übergangsmetalle mit dieser Methode ignorieren, die Gruppen 3-12 enthält.