Das Bestehen eines allgemeinen Chemie-Kurses erfordert ein gutes Verständnis der Grundlagen, die Fähigkeit, einige Grundrechenarten zu machen, einen Taschenrechner für fortgeschrittene Gleichungen und die Bereitschaft, Wissen über ein komplexes Thema zu erlangen. Chemie ist das Studium der Materie und ihrer Eigenschaften. Alles um dich herum beinhaltet Chemie. Selbst einfache Dinge, die Sie als selbstverständlich ansehen, wie das Wasser, das Sie trinken, und die Luft, die Sie atmen. Seien Sie offen, wenn Sie lernen, was überall um Sie herum geschieht, bis auf atomare Ebene. Ihre erste Begegnung mit Chemie kann herausfordernd und spannend sein.
Teil eins von acht:
Atomare Strukturen verstehen
-
 1 Beginnen Sie mit den grundlegendsten Strukturen. Um deinen Chemieunterricht zu bestehen, musst du die Bausteine gut verstehen, die alles ausmachen, was Substanz oder Masse hat.
1 Beginnen Sie mit den grundlegendsten Strukturen. Um deinen Chemieunterricht zu bestehen, musst du die Bausteine gut verstehen, die alles ausmachen, was Substanz oder Masse hat. - Das Atom ist da, wo die Chemie anfängt. Alles in der Klasse wird eine Erweiterung sein, basierend auf diesen grundlegenden Informationen. Stellen Sie sicher, dass Sie sich die Zeit nehmen, um das auf Atomen präsentierte Material zu verstehen.
-
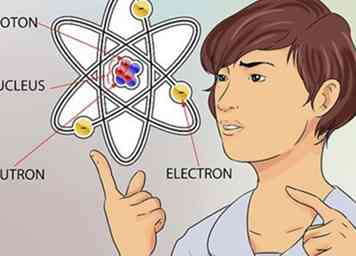 2 Fassen Sie das Konzept eines Atoms. Ein Atom gilt als der kleinste Baustein von allem, was Masse hat, einschließlich Dinge, die wir nicht immer sehen können, wie Gase. Aber selbst das winzige Atom hat noch kleinere Teile, die seine Struktur ausmachen.[1]
2 Fassen Sie das Konzept eines Atoms. Ein Atom gilt als der kleinste Baustein von allem, was Masse hat, einschließlich Dinge, die wir nicht immer sehen können, wie Gase. Aber selbst das winzige Atom hat noch kleinere Teile, die seine Struktur ausmachen.[1] - Ein Atom besteht aus 3 Teilen. Diese Teile sind Neutronen, Protonen und Elektronen. Das Zentrum des Atoms heißt der Kern. Der Kern besteht aus Neutronen und Protonen. Elektronen sind die Teilchen, die um den äußeren Teil des Atoms schweben, wie Planeten, die die Sonne umkreisen.[2]
- Die Größe eines Atoms ist unglaublich klein. Denken Sie an die größte Sportarena, die Sie kennen, vielleicht an den Houston Astrodome. Wenn Sie das Astrodom als Atom betrachten, dann ist der Kern dieses Atoms etwa erbsengroß, irgendwo um die 50-Yard-Linie.[3]
-
 3 Verstehen Sie den atomaren Rahmen eines Elements. Ein Element wird als eine Substanz in der Natur angesehen, die nicht in irgendein anderes Element oder andere einfachere Formen zerlegt werden kann. Elemente bestehen aus Atomen.[4]
3 Verstehen Sie den atomaren Rahmen eines Elements. Ein Element wird als eine Substanz in der Natur angesehen, die nicht in irgendein anderes Element oder andere einfachere Formen zerlegt werden kann. Elemente bestehen aus Atomen.[4] - Die Atome eines bestimmten Elements sind immer gleich. Dies bedeutet, dass jedes Element eine bekannte und einzigartige Anzahl von Neutronen und Protonen in seiner Atomstruktur hat.[5]
-
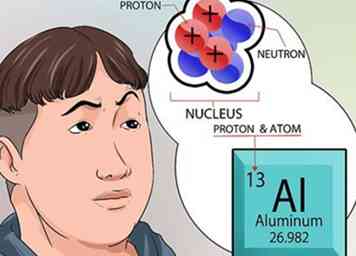 4 Versteht mehr über den Nukleus. Die im Kern vorhandenen Neutronen sind neutral geladen. Protonen haben eine positive Ladung. Die Ordnungszahl eines Elements ist genau die gleiche wie die Anzahl der Protonen im Kern.[6]
4 Versteht mehr über den Nukleus. Die im Kern vorhandenen Neutronen sind neutral geladen. Protonen haben eine positive Ladung. Die Ordnungszahl eines Elements ist genau die gleiche wie die Anzahl der Protonen im Kern.[6] - Sie müssen nichts berechnen, um die Anzahl der Protonen im Kern eines Elements zu kennen. Diese Zahl steht oben auf jeder quadratischen Box für jedes Element im Periodensystem.
-
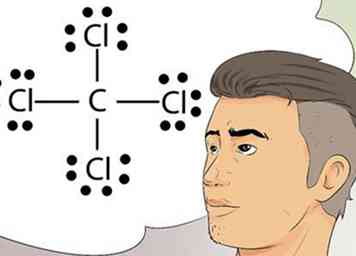 5 Erkennen Sie Lewis-Diagramme. Lewis-Diagramme werden manchmal Elektron-Punkt-Diagramme genannt. Dies sind einfache Diagramme, die Punkte zur Darstellung der gepaarten und ungepaarten Elektronen in der äußeren Schale eines Atoms verwenden.[7]
5 Erkennen Sie Lewis-Diagramme. Lewis-Diagramme werden manchmal Elektron-Punkt-Diagramme genannt. Dies sind einfache Diagramme, die Punkte zur Darstellung der gepaarten und ungepaarten Elektronen in der äußeren Schale eines Atoms verwenden.[7] - Lewis-Strukturen sind nützlich beim Zeichnen einfacher Diagramme, die Bindungen, wie kovalente Bindungen, identifizieren, die zwischen Elementen in einem Atom oder Molekül geteilt werden.[8]
-
 6 Wissen Sie, was die Oktettregel bedeutet. Lewis-Diagramme arbeiten nach der Oktettregel, die besagt, dass Atome stabil sind, wenn sie Zugang zu acht Elektronen in der äußeren Schale haben. Wasserstoff ist die Ausnahme und gilt als stabil mit zwei Elektronen in der äußeren Schale.[9]
6 Wissen Sie, was die Oktettregel bedeutet. Lewis-Diagramme arbeiten nach der Oktettregel, die besagt, dass Atome stabil sind, wenn sie Zugang zu acht Elektronen in der äußeren Schale haben. Wasserstoff ist die Ausnahme und gilt als stabil mit zwei Elektronen in der äußeren Schale.[9] -
 7 Zeichnen Sie ein Lewis-Diagramm. Das Symbol für ein Element, umgeben von einer Anordnung von Punkten, ist ein Lewis-Diagramm. Stellen Sie sich das Diagramm als Standbild eines Films vor. Anstatt der Elektronen, die um die Außenseite des Elements wirbeln, werden sie als ein fester Zeitpunkt dargestellt.[10]
7 Zeichnen Sie ein Lewis-Diagramm. Das Symbol für ein Element, umgeben von einer Anordnung von Punkten, ist ein Lewis-Diagramm. Stellen Sie sich das Diagramm als Standbild eines Films vor. Anstatt der Elektronen, die um die Außenseite des Elements wirbeln, werden sie als ein fester Zeitpunkt dargestellt.[10] - Das Diagramm zeigt die stabile Anordnung von Elektronen, wo sie an das nächste Element binden, und Informationen über die Stärke der Bindungen, wie wenn die Bindungen geteilt oder verdoppelt werden.
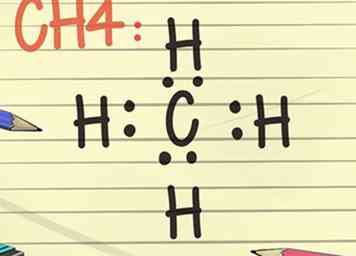
- Denken Sie über die Oktettregel nach und stellen Sie sich das Symbol für ein Element vor, vielleicht C für Kohlenstoff. Platziere oder zeichne nun 2 Punkte an jeder Kompassposition, also 2 Punkte nördlich von C, Osten, Westen und Süden. Stellen Sie sich nun ein H vor, das ein Wasserstoffatom auf der anderen Seite jedes der 2 Punkte darstellt. Dieses abgeschlossene Lewis-Diagramm bedeutet, dass das einzelne Kohlenstoffatom im Zentrum von 4 Wasserstoffatomen umgeben ist. Die Elektronen sind kovalent gebunden, dh die Kohlenstoff- und Wasserstoffatome teilen sich eines ihrer Elektronen, um sich miteinander zu verbinden.[11]
- Die Molekülformel für dieses Beispiel ist CH4 und ist die Formel für Methangas.
-
 8 Verstehen Sie die Anordnung von Elektronen, wie sie Elemente miteinander verbinden. Die Lewis-Diagramme sind eine vereinfachte visuelle Darstellung dessen, was unter chemischen Bindungen verstanden wird.
8 Verstehen Sie die Anordnung von Elektronen, wie sie Elemente miteinander verbinden. Die Lewis-Diagramme sind eine vereinfachte visuelle Darstellung dessen, was unter chemischen Bindungen verstanden wird. - Sprechen Sie mit Ihrem Professor oder Mitgliedern Ihrer Arbeitsgruppe, wenn die Konzepte über chemische Bindung und Lewis-Diagramme nicht klar sind.
Teil Zwei von Acht:
Das Periodensystem lesen und verstehen
-
 1 Schau dir das Periodensystem an. Wenn Sie Probleme mit den Eigenschaften von Elementen haben, sollten Sie einige Zeit damit verbringen, das verfügbare Material im Periodensystem zu überprüfen. Am wichtigsten, schauen Sie sich genau einen an.
1 Schau dir das Periodensystem an. Wenn Sie Probleme mit den Eigenschaften von Elementen haben, sollten Sie einige Zeit damit verbringen, das verfügbare Material im Periodensystem zu überprüfen. Am wichtigsten, schauen Sie sich genau einen an. - Das Verständnis des Periodensystems ist entscheidend, um den ersten Teil des Chemieunterrichts zu bestehen.
- 2 Identifizieren Sie die Elemente im Periodensystem. Das Periodensystem besteht nur aus Elementen. Jedes Element hat ein Symbol, das aus einem oder zwei Buchstaben besteht. Dieses Symbol identifiziert immer dieses Element. Na zum Beispiel bedeutet immer Natrium. Der vollständige Name des Elements erscheint direkt unter dem Symbol.[12]
- 3 Suchen Sie die Ordnungszahl jedes Elements. Die Zahl über dem Symbol ist die Ordnungszahl. Die Ordnungszahl ist die gleiche wie die Anzahl der Protonen im Kern.[13]
-
 4 Finde die atomare Masse jedes Elements. Die Zahl unten ist die atomare Masse. Denken Sie daran, dass die Anzahl der Protonen in Kombination mit der Anzahl der Neutronen, die im Kern gefunden werden, gleich der Atommasse ist.[14]
4 Finde die atomare Masse jedes Elements. Die Zahl unten ist die atomare Masse. Denken Sie daran, dass die Anzahl der Protonen in Kombination mit der Anzahl der Neutronen, die im Kern gefunden werden, gleich der Atommasse ist.[14] -
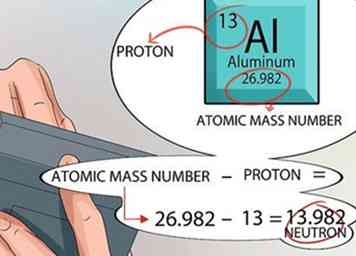 5 Berechnen Sie die Anzahl der im Kern gefundenen Neutronen. Sie können die Zahlen aus dem Periodensystem verwenden, um dies herauszufinden. Die Ordnungszahl für jedes Element ist genau die gleiche wie die Anzahl der Protonen im Kern.
5 Berechnen Sie die Anzahl der im Kern gefundenen Neutronen. Sie können die Zahlen aus dem Periodensystem verwenden, um dies herauszufinden. Die Ordnungszahl für jedes Element ist genau die gleiche wie die Anzahl der Protonen im Kern. - Die atomare Masseneinheit wird für jedes Element innerhalb des Quadrates unten gedruckt, genau unter dem Namen des Elements.
- Denken Sie daran, dass die einzigen zwei Dinge, die sich im Kern eines Atoms befinden, Protonen und Neutronen sind. Das Periodensystem teilt Ihnen die Anzahl der Protonen mit und zeigt Ihnen die atomare Massenzahl an.
- Von diesem Punkt an ist die Mathematik einfach. Subtrahiere die Anzahl der Protonen von der atomaren Massenzahl, und das gibt dir die Anzahl der Neutronen im Kern jedes Atoms für dieses Element.[15]
-
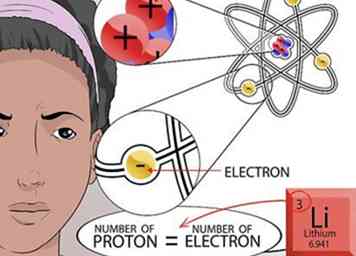 6 Finde die Anzahl der Elektronen heraus. Denken Sie daran, dass Gegensätze anziehen. Elektronen sind positiv geladene Teilchen, die um den Kern eines Atoms fliegen wie Planeten, die die Sonne umkreisen. Die Anzahl der negativ geladenen Elektronen, die zum Kern gezogen werden, hängt von der Anzahl der positiv geladenen Protonen im Kern ab.
6 Finde die Anzahl der Elektronen heraus. Denken Sie daran, dass Gegensätze anziehen. Elektronen sind positiv geladene Teilchen, die um den Kern eines Atoms fliegen wie Planeten, die die Sonne umkreisen. Die Anzahl der negativ geladenen Elektronen, die zum Kern gezogen werden, hängt von der Anzahl der positiv geladenen Protonen im Kern ab. - Da ein Atom keine Gesamtladung hat, müssen alle positiven und negativen Ladungen des Atoms ausgeglichen sein. Daher ist die Anzahl der Elektronen gleich der Anzahl der Protonen.[16]
Teil Drei von Acht:
Vorhersage chemischer Reaktionen
-
 1 Balance eine chemische Gleichung. In einem Chemieunterricht wird erwartet, dass Sie wissen, wie Sie vorhersagen können, was passiert, wenn Elemente kombiniert werden. Auf dem Papier wird dies als Ausgleich chemischer Gleichungen bezeichnet.[17]
1 Balance eine chemische Gleichung. In einem Chemieunterricht wird erwartet, dass Sie wissen, wie Sie vorhersagen können, was passiert, wenn Elemente kombiniert werden. Auf dem Papier wird dies als Ausgleich chemischer Gleichungen bezeichnet.[17] - Das Format für eine chemische Gleichung besteht aus Reaktanten auf der linken Seite der Gleichung, dann einem Pfeil in der Richtung der Produkte der Gleichung, dann die Produkte. Die Teile auf der einen Seite der Gleichung müssen die Teile auf der anderen Seite ausgleichen.[18]
- Zum Beispiel Reaktant 1 + Reaktant 2 → Produkt 1 + Produkt 2
- Hier ist ein Beispiel mit den Symbolen für Zinn, das Sn ist, in seiner oxidierten Form, das SnO2 ist, kombiniert mit Wasserstoffgas, das als H2 geschrieben wird. SnO2 + H2 → Sn + H2O.
- Diese Gleichung ist jedoch nicht ausgeglichen, da die Menge der Reaktanten der Menge der Produkte entsprechen muss. Die linke Seite hat ein mehr Sauerstoffatom als die rechte Seite.[19]
- Verwenden Sie Grundrechenarten, um die Gleichung auszubalancieren, indem Sie 2 Wasserstoffeinheiten auf der linken Seite der Gleichung und 2 Wassermoleküle auf der rechten Seite angeben. Die endgültige ausgeglichene Gleichung sieht so aus: SnO2 + 2 H2 → Sn + 2 H2O.[20]
-
 2 Denken Sie über die Gleichungen anders nach. Wenn Sie Probleme beim Ausgleichen von chemischen Gleichungen haben, denken Sie über die Gleichung als Teil eines Rezepts nach, das jedoch auf beiden Seiten angepasst werden muss, damit Sie weniger aus Ihrem Rezept machen können.
2 Denken Sie über die Gleichungen anders nach. Wenn Sie Probleme beim Ausgleichen von chemischen Gleichungen haben, denken Sie über die Gleichung als Teil eines Rezepts nach, das jedoch auf beiden Seiten angepasst werden muss, damit Sie weniger aus Ihrem Rezept machen können. - Die Gleichung gibt Ihnen die Zutaten, auf der linken Seite der Gleichung, aber sagt Ihnen nicht, wie viel von jeder Zutat zu verwenden. Die Gleichung sagt Ihnen auch, was die Produkte enthalten werden, sagt Ihnen aber nicht die Menge der Produkte. Das musst du herausfinden.
- Wenn Sie das vorherige Beispiel SnO2 + H2 → Sn + H2O verwenden, überlegen Sie, warum diese Gleichung oder Rezeptformel nicht funktioniert. Die Sn-Teile sind auf beiden Seiten gleich und die H2-Teile sind auf beiden Seiten gleich. Aber die linke Seite hat 2 Sauerstoffteile und die rechte Seite hat nur 1 Sauerstoff.
- Ändern Sie die rechte Seite der Gleichung, um anzuzeigen, dass das Produkt 2 H2O-Teile enthält. Die 2 vor dem H2O bedeutet, dass alle Mengen in dieser Gruppierung nun verdoppelt sind. Jetzt ist der Sauerstoff ausgeglichen, aber wenn man die 2 addiert, gibt es mehr Wasserstoff auf der rechten Seite der Gleichung als auf der linken Seite. Gehe zurück nach links und ändere die H2-Zutat um das Zweifache, indem du eine 2 vor den H2 stellst.
- Jetzt haben Sie die Zutaten auf beiden Seiten der Gleichung angepasst. Was in das Rezept passt und was herauskommt, sind gleich oder ausgewogen.
-
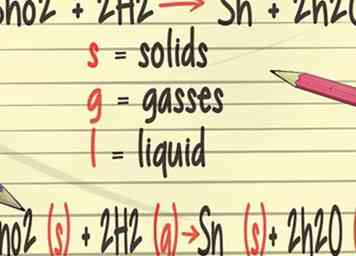 3 Fügen Sie Ihren ausgeglichenen Gleichungen mehr Details hinzu. In deinem Chemieunterricht lernst du, Symbole zu deinen ausgeglichenen Gleichungen hinzuzufügen, die den physikalischen Zustand der Elemente darstellen. Diese Symbole umfassen (s) für Feststoffe, (g) für Gase und (l) für Flüssigkeiten.[21]
3 Fügen Sie Ihren ausgeglichenen Gleichungen mehr Details hinzu. In deinem Chemieunterricht lernst du, Symbole zu deinen ausgeglichenen Gleichungen hinzuzufügen, die den physikalischen Zustand der Elemente darstellen. Diese Symbole umfassen (s) für Feststoffe, (g) für Gase und (l) für Flüssigkeiten.[21] -
 4 Identifizieren Sie Veränderungen, die bei einer chemischen Reaktion auftreten. Chemische Reaktionen beginnen mit den Grundelementen oder bereits kombinierten Elementen, die Reaktanten genannt werden. Die Kombination von zwei oder mehr Reaktanten zusammen ergibt ein einzelnes Produkt oder mehrere Produkte.
4 Identifizieren Sie Veränderungen, die bei einer chemischen Reaktion auftreten. Chemische Reaktionen beginnen mit den Grundelementen oder bereits kombinierten Elementen, die Reaktanten genannt werden. Die Kombination von zwei oder mehr Reaktanten zusammen ergibt ein einzelnes Produkt oder mehrere Produkte. - Um die Chemie zu bestehen, müssen Sie wissen, wie man Gleichungen löst, die chemische Reaktanten, Produkte und die Einführung eines anderen Einflusses beinhalten, der entweder die Reaktanten, Produkte oder beides verändert.[22]
Teil Vier von Acht:
Chemische Reaktionen identifizieren
-
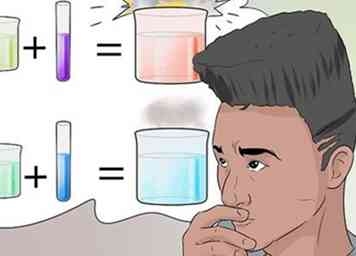 1 Erkennen Sie die Arten von Reaktionen. Chemische Reaktionen können als Ergebnis vieler Einflüsse auftreten, zusätzlich zur einfachen Kombination von Inhaltsstoffen.
1 Erkennen Sie die Arten von Reaktionen. Chemische Reaktionen können als Ergebnis vieler Einflüsse auftreten, zusätzlich zur einfachen Kombination von Inhaltsstoffen. - Zu den üblichen Arten chemischer Reaktionen, die Sie erwarten können, gehören Synthese, Analyse, Substitution, doppelte Verdrängung, Säure-Base-Oxidation, Reduktion, Verbrennung, Isomerisierung und Hydrolyse.[23]
- Die Arten von Reaktionen, die in Ihrem Chemieunterricht angeboten werden, können je nach den Zielen der einzelnen Klassen variieren. High-School-Chemie bietet möglicherweise nicht das gleiche Maß an Details wie die Chemie an einer Hochschule oder Universität.
-
 2 Verwenden Sie die bereitgestellten Ressourcen. Sie müssen die Unterschiede in jeder Art von Reaktion erfassen, die in Ihrer Klasse behandelt werden. Verwenden Sie Ressourcen, die Ihnen von Ihrem Lehrer oder Professor zur Verfügung gestellt wurden, um die verschiedenen Reaktionstypen in Ihrer Klasse zu verstehen. Haben Sie keine Angst, Fragen zu stellen.
2 Verwenden Sie die bereitgestellten Ressourcen. Sie müssen die Unterschiede in jeder Art von Reaktion erfassen, die in Ihrer Klasse behandelt werden. Verwenden Sie Ressourcen, die Ihnen von Ihrem Lehrer oder Professor zur Verfügung gestellt wurden, um die verschiedenen Reaktionstypen in Ihrer Klasse zu verstehen. Haben Sie keine Angst, Fragen zu stellen. - Das Verständnis der Veränderungen, die bei verschiedenen Arten von chemischen Reaktionen auftreten, kann verwirrend sein. Zu verstehen, was bei bestimmten chemischen Reaktionen passiert, kann ein schwieriger Abschnitt in Ihrem Chemieunterricht sein.
-
 3 Denken Sie über chemische Reaktionen logisch nach. Versuchen Sie, es nicht schwerer zu machen, als es bereits ist, indem Sie sich in der Terminologie verfangen.Bei den Arten chemischer Reaktionen, die Sie lernen werden, müssen Sie einfach etwas tun, um etwas zu verändern.
3 Denken Sie über chemische Reaktionen logisch nach. Versuchen Sie, es nicht schwerer zu machen, als es bereits ist, indem Sie sich in der Terminologie verfangen.Bei den Arten chemischer Reaktionen, die Sie lernen werden, müssen Sie einfach etwas tun, um etwas zu verändern. - Zum Beispiel, Sie wissen bereits, was passiert, wenn Sie 2 Wasserstoffatome mit 1 Sauerstoffatom kombinieren, erhalten Sie Wasser. Wenn du also das Wasser, das du gerade in einen Topf getan hast, mit Hitze auf den Herd stellst, ändert sich etwas. Sie haben eine chemische Reaktion erzeugt. Wenn Sie das Wasser in den Gefrierschrank geben, das gleiche. Sie haben eine Änderung eingeführt, die den ursprünglichen Reaktanten verändert hat, in diesem Fall Wasser.
- Gehen Sie jede Reaktion einzeln nacheinander durch, bis Sie sie verstanden haben, und gehen Sie dann zum nächsten Typ über. Konzentrieren Sie sich auf die Energiequelle, die die Reaktion steuert, und auf die primären Änderungen, die sich daraus ergeben.
- Wenn Sie Schwierigkeiten in diesem Bereich haben, machen Sie eine Liste von dem, was für Sie verwirrend ist, und besprechen Sie es mit Ihrem Professor, Ihrer Studiengruppe oder jemandem, der Chemie gut kennt.
Teil Fünf von Acht:
Die Sprache der Chemie benutzen
-
 1 Erfahren Sie, wie Verbindungen benannt werden. Die Chemie hat ihre eigenen Regeln für die Nomenklatur. Die Arten von Reaktionen, die chemischen Verbindungen passieren, der Verlust oder Gewinn von Elektronen in ihrer äußeren Hülle und die Stabilität oder Instabilität von Verbindungen sind Teil der chemischen Nomenklatur.
1 Erfahren Sie, wie Verbindungen benannt werden. Die Chemie hat ihre eigenen Regeln für die Nomenklatur. Die Arten von Reaktionen, die chemischen Verbindungen passieren, der Verlust oder Gewinn von Elektronen in ihrer äußeren Hülle und die Stabilität oder Instabilität von Verbindungen sind Teil der chemischen Nomenklatur. -
 2 Nehmen Sie den Abschnitt über die Nomenklatur ernst. Die meisten Anfänger-Chemie-Klassen haben einen Abschnitt, der nur der Nomenklatur gewidmet ist. In einigen Schulen bedeutet das Versäumnis, den Nomenklatur-Teil der Klasse zu bestehen, das Scheitern der Klasse.
2 Nehmen Sie den Abschnitt über die Nomenklatur ernst. Die meisten Anfänger-Chemie-Klassen haben einen Abschnitt, der nur der Nomenklatur gewidmet ist. In einigen Schulen bedeutet das Versäumnis, den Nomenklatur-Teil der Klasse zu bestehen, das Scheitern der Klasse. - Wenn möglich, arbeiten Sie an der Nomenklatur, bevor Sie mit dem Unterricht beginnen. Viele Arbeitsmappen sind zum Kauf oder Online-Zugriff verfügbar.
-
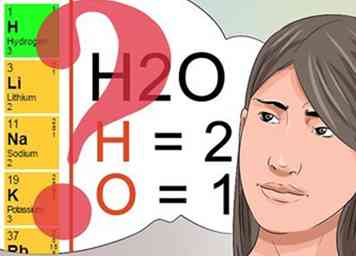 3 Wissen, was hochgestellte und tiefgestellte Zahlen anzeigen. Zu verstehen, was hochgestellte und tiefgestellte Zahlen bedeuten, ist entscheidend für das Bestehen des Chemieunterrichts.[24]
3 Wissen, was hochgestellte und tiefgestellte Zahlen anzeigen. Zu verstehen, was hochgestellte und tiefgestellte Zahlen bedeuten, ist entscheidend für das Bestehen des Chemieunterrichts.[24] - Die hochgestellten Zahlen folgen einem im Periodensystem gefundenen Muster und zeigen die Gesamtladung des Elements oder der chemischen Verbindung an. Überprüfen Sie das Periodensystem, um Elemente in vertikalen Zeilen mit denselben hochgestellten Zahlen anzuzeigen.
- Tiefgestellte Zahlen werden verwendet, um die Menge jedes identifizierten Elements zu identifizieren, das Teil der chemischen Verbindung ist. Wie bereits erwähnt, besagt der Index von 2 im Molekül H2O, dass es zwei Wasserstoffatome als Teil dieses Moleküls gibt.
-
 4 Erkenne, wie Atome miteinander reagieren. Ein Teil der in der Chemie verwendeten Nomenklatur beinhaltet spezifische Regeln für die Benennung der Produkte aus bestimmten Arten von Reaktionen.[25]
4 Erkenne, wie Atome miteinander reagieren. Ein Teil der in der Chemie verwendeten Nomenklatur beinhaltet spezifische Regeln für die Benennung der Produkte aus bestimmten Arten von Reaktionen.[25] - Eine dieser Reaktionen ist die oxidative Reduktionsreaktion. Diese Reaktion beinhaltet den Prozess, entweder Elektronen zu gewinnen oder zu verlieren.
- Eine einfache Möglichkeit, sich an den Prozess zu erinnern, ist, sich an den Satz "LEO, der Löwe sagt GER" zu erinnern. Dies steht für Verlust von Elektronen in der Oxidation und Verstärkung von Elektronen in der Reduktion.[26]
-
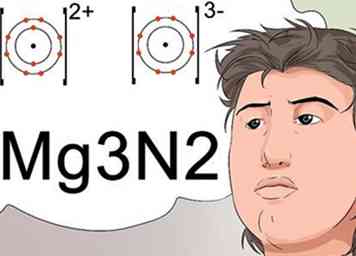 5 Erkenne, dass Indizes die Formel für eine stabile Ladung einer Verbindung anzeigen können. Wissenschaftler verwenden Subskripte, um die endgültige molekulare Formel einer Verbindung zu identifizieren, die auch eine stabile Verbindung mit einer neutralen Ladung anzeigt.
5 Erkenne, dass Indizes die Formel für eine stabile Ladung einer Verbindung anzeigen können. Wissenschaftler verwenden Subskripte, um die endgültige molekulare Formel einer Verbindung zu identifizieren, die auch eine stabile Verbindung mit einer neutralen Ladung anzeigt. - Um eine neutrale Ladung zu erzeugen, muss das positiv geladene Ion, das als Kation bezeichnet wird, durch eine gleiche Ladung von einem negativen Ion, einem so genannten Anion, ausgeglichen werden. Die Gebühren sind als hochgestellt gekennzeichnet.[27]
- Zum Beispiel trägt das Magnesiumion eine Ladung von +2 Kationen, und das Stickstoffion hat eine Ladung von -3 Anionen. Die +2 und -3 würden als hochgestellt angezeigt werden. Um die beiden Elemente richtig zu kombinieren, um eine neutrale Ladung zu erhalten, werden 3 Magnesiumatome für jeweils 2 Stickstoffelemente verwendet.[28]
- Die Nomenklatur, die dies identifiziert, verwendet Indices und wird als Mg3N2 geschrieben.[29]
-
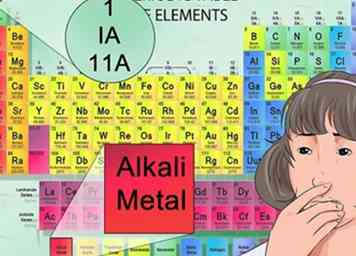
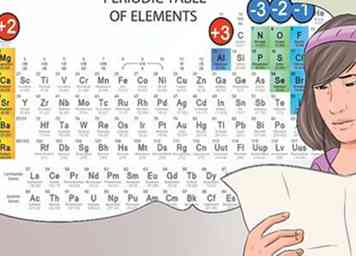 6 Identifizieren Sie Anionen und Kationen anhand ihrer Position im Periodensystem. Die Elemente des Periodensystems, die in die erste Spalte der Elemente fallen, werden als Alkalien betrachtet und bilden +1 Kationenladungen. Zum Beispiel Na + und Li +.[30]
6 Identifizieren Sie Anionen und Kationen anhand ihrer Position im Periodensystem. Die Elemente des Periodensystems, die in die erste Spalte der Elemente fallen, werden als Alkalien betrachtet und bilden +1 Kationenladungen. Zum Beispiel Na + und Li +.[30] - Die Erdalkalimetalle, die in der zweiten Säule gefunden werden, bilden 2+ Kationen, wie Mg2 + und Ba2 +.[31]
- Elemente in der siebten Spalte werden Halogene genannt und bilden -1 Anionen, wie Cl- und I-.[32]
-
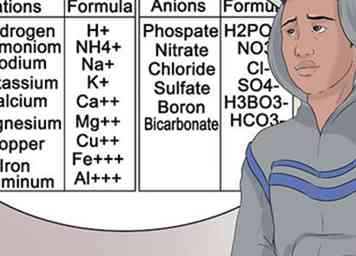 7 Lerne die allgemeineren Anionen und Kationen zu erkennen. Um Ihnen zu helfen, Ihren Chemieunterricht zu bestehen, sollten Sie sich so gut wie möglich mit der Nomenklatur vertraut machen, die an Elementgruppen gebunden ist. Diese Art von Hochschrift ändert sich nicht.[33]
7 Lerne die allgemeineren Anionen und Kationen zu erkennen. Um Ihnen zu helfen, Ihren Chemieunterricht zu bestehen, sollten Sie sich so gut wie möglich mit der Nomenklatur vertraut machen, die an Elementgruppen gebunden ist. Diese Art von Hochschrift ändert sich nicht.[33] - Mit anderen Worten, Magnesium wird immer als Mg dargestellt und trägt immer eine Kationenladung von +2.[34]
-
 8 Stellen Sie sich Chemie als eine neue Sprache vor. Verstehen Sie, dass die geschriebenen Formen der Anzeige von Ladungen, die Anzahl der Atome in einem Molekül und die Bindungen, die gebildet werden, um Moleküle zusammenzuhalten, alle Teil der Sprache der Chemie sind. All dies ist eine schriftliche Art zu repräsentieren, was in den chemischen Reaktionen passiert, die nicht wirklich gesehen werden können.
8 Stellen Sie sich Chemie als eine neue Sprache vor. Verstehen Sie, dass die geschriebenen Formen der Anzeige von Ladungen, die Anzahl der Atome in einem Molekül und die Bindungen, die gebildet werden, um Moleküle zusammenzuhalten, alle Teil der Sprache der Chemie sind. All dies ist eine schriftliche Art zu repräsentieren, was in den chemischen Reaktionen passiert, die nicht wirklich gesehen werden können. - Es wäre so viel einfacher zu verstehen, wenn alles sichtbar wäre, direkt vor dir. Aber neben all der Chemie, die passiert, muss man auch die Sprache verstehen, in der alles, was mit Chemie zu tun hat, aufgezeichnet und dargestellt wird.
- Wenn es Ihnen schwer fällt, Chemie zu verstehen, dann stellen Sie fest, dass Sie nicht allein sind, aber lassen Sie sich davon nicht beeindrucken. Sprich mit deinem Professor, deiner Lerngruppe, einem Lehrassistenten oder jemandem, der wirklich gut in der Chemie ist. Sie können all dies lernen, aber es kann hilfreich sein, wenn es auf eine Weise erklärt werden kann, die für Sie Sinn ergibt.
Teil Sechs von Acht:
Die Mathematik machen
-
 1 Kennen Sie die Reihenfolge für grundlegende mathematische Berechnungen. In der Chemie werden manchmal sehr detaillierte Berechnungen benötigt, aber zu anderen Zeiten sind nur grundlegende mathematische Fähigkeiten ausreichend. Es ist wichtig, die richtige Reihenfolge für das Ausführen von Berechnungen in einer Gleichung zu verstehen.[35]
1 Kennen Sie die Reihenfolge für grundlegende mathematische Berechnungen. In der Chemie werden manchmal sehr detaillierte Berechnungen benötigt, aber zu anderen Zeiten sind nur grundlegende mathematische Fähigkeiten ausreichend. Es ist wichtig, die richtige Reihenfolge für das Ausführen von Berechnungen in einer Gleichung zu verstehen.[35] - Merken Sie sich einen hilfreichen Satz. Der Satz "bitte entschuldige meine liebe Tante Sally" sagt dir, welche Anwendungen zuerst ausgeführt werden sollen. Der erste Buchstabe jedes Wortes gibt die zu verwendende Reihenfolge an.Alles in Klammern wird zuerst ausgeführt, dann Potenzierung, Multiplikation oder Division, die letzte Addition oder Subtraktion.
- Vervollständigen Sie die Berechnung 3 + 2 x 6 = ___, indem Sie Ihre Schritte gemäß dem Ausdruck bestellen. Die Antwort auf die Gleichung ist 15.
-
 2 Machen Sie es sich bequem, sehr große Zahlen zu runden. Während das Runden von Zahlen nicht für die Chemie einzigartig ist, führen die Antworten auf einige der komplexen mathematischen Gleichungen zu Zahlen, die zu lang zum Schreiben sind. Achten Sie genau auf die Anweisungen, die Sie beim Runden Ihrer Antworten erhalten.[36]
2 Machen Sie es sich bequem, sehr große Zahlen zu runden. Während das Runden von Zahlen nicht für die Chemie einzigartig ist, führen die Antworten auf einige der komplexen mathematischen Gleichungen zu Zahlen, die zu lang zum Schreiben sind. Achten Sie genau auf die Anweisungen, die Sie beim Runden Ihrer Antworten erhalten.[36] - Wissen, wo man auf- oder abrundet. Wenn die nächste Ziffer in der Reihe eine 4 oder weniger ist, dann runden Sie ab, und wenn es eine 5 oder mehr Runde ist. Betrachten Sie zum Beispiel die Nummer 6.66666666666666. Sie werden gebeten, Ihre Antwort auf die zweite Dezimalstelle zu runden. Die Antwort ist 6.67.[37]
-
 3 Verstehen Sie den absoluten Wert. In der Chemie werden einige Zahlen als absoluter Wert und nicht als ihr tatsächlicher mathematischer Wert bezeichnet. Der absolute Wert ist der Abstand von der Zahl zu Null.
3 Verstehen Sie den absoluten Wert. In der Chemie werden einige Zahlen als absoluter Wert und nicht als ihr tatsächlicher mathematischer Wert bezeichnet. Der absolute Wert ist der Abstand von der Zahl zu Null. - Mit anderen Worten, Sie betrachten nicht mehr nur Positiv oder Negativ, sondern nur die Entfernung zu Null. Zum Beispiel ist der absolute Wert von -20 20.[38]
-
 4 Vertraut sein mit den akzeptierten Maßeinheiten. Hier sind ein paar Beispiele.
4 Vertraut sein mit den akzeptierten Maßeinheiten. Hier sind ein paar Beispiele. - Die Maße der Materie sind in Mol (Mol) ausgedrückt.
- Die Temperatur wird in Grad Fahrenheit (° F), Kelvin (° K) oder Celsius (° C) ausgedrückt.
- Die Masse wird in Gramm (g), Kilogramm (kg) oder Milligramm (mg) ausgedrückt.
- Flüssigkeitsmaße werden in Liter (L) oder Millilitern (ml) ausgedrückt.
-
 5 Üben Sie die Umstellung von einer Maßeinheit auf eine andere. Ein Teil des Chemieunterrichts besteht darin, dass Sie Conversions von einer akzeptierten Skala in eine andere durchführen. Dies kann den Wechsel von einer Temperaturmessung zu einer anderen umfassen, wobei Pfund in Kilogramm und Unzen in Liter geändert werden.
5 Üben Sie die Umstellung von einer Maßeinheit auf eine andere. Ein Teil des Chemieunterrichts besteht darin, dass Sie Conversions von einer akzeptierten Skala in eine andere durchführen. Dies kann den Wechsel von einer Temperaturmessung zu einer anderen umfassen, wobei Pfund in Kilogramm und Unzen in Liter geändert werden. - Sie werden möglicherweise aufgefordert, Antworten in anderen Einheiten als in der ursprünglichen Frage anzugeben. Zum Beispiel können Sie eine Temperaturgleichung erhalten, um in Celsius zu lösen, und gebeten werden, die endgültige Antwort in Kelvin zu geben.
- Kelvin ist der internationale Standard für Temperaturmessungen, die häufig in chemischen Reaktionen verwendet werden. Üben Sie den Wechsel von Grad Celsius zu Grad Kelvin oder Fahrenheit.
-
 6 Nimm dir Zeit zum Üben. Da Sie in Ihrer Klasse verschiedenen Conversions ausgesetzt sind, sollten Sie sich die Zeit nehmen, um zu lernen, wie Sie von einem zum anderen und wieder zurück konvertieren können.
6 Nimm dir Zeit zum Üben. Da Sie in Ihrer Klasse verschiedenen Conversions ausgesetzt sind, sollten Sie sich die Zeit nehmen, um zu lernen, wie Sie von einem zum anderen und wieder zurück konvertieren können. -
 7 Wissen, wie man Konzentrationen berechnet. Schärfen Sie Ihre grundlegenden mathematischen Fähigkeiten in den Bereichen Prozentsätze, Verhältnisse und Proportionen.
7 Wissen, wie man Konzentrationen berechnet. Schärfen Sie Ihre grundlegenden mathematischen Fähigkeiten in den Bereichen Prozentsätze, Verhältnisse und Proportionen. -
 8 Üben Sie mit Nährwertkennzeichnungen auf Lebensmitteln. Um die Chemie zu bestehen, müssen Sie bequem sein, Verhältnisse, Proportionen, Prozentsätze und dann wieder zurück zu berechnen. Wenn dies für Sie schwierig ist, sollten Sie andere gebräuchliche Maßeinheiten verwenden, wie z. B. auf Lebensmitteletiketten.
8 Üben Sie mit Nährwertkennzeichnungen auf Lebensmitteln. Um die Chemie zu bestehen, müssen Sie bequem sein, Verhältnisse, Proportionen, Prozentsätze und dann wieder zurück zu berechnen. Wenn dies für Sie schwierig ist, sollten Sie andere gebräuchliche Maßeinheiten verwenden, wie z. B. auf Lebensmitteletiketten. - Sehen Sie sich das Nährwertschild eines Lebensmittels an. Sie werden sehen, Kalorien pro Portion, Prozent der RDAs, Gesamtfett, Kalorien aus Fett, insgesamt Kohlenhydrate und eine Aufschlüsselung der verschiedenen Arten von Kohlenhydraten. Üben Sie, indem Sie verschiedene Verhältnisse und Proportionen unter Verwendung verschiedener Kategorien für die untere Zahl berechnen.
- Berechnen Sie beispielsweise die Menge an einfach ungesättigtem Fett pro Gesamtfettmenge. Ändere dies zu einem Prozent. Berechnen Sie, wie viele Kalorien im gesamten Behälter enthalten sind, indem Sie die angegebenen Zahlen für Kalorien pro Portion und Portionen pro Behälter verwenden. Berechnen Sie, wie viel Natrium in ½ des vollen Behälters enthalten ist.
- Indem Sie solche Umrechnungen durchführen, unabhängig von den verwendeten Einheiten, werden Sie diese Maßeinheiten für chemische Messungen, wie z. B. Mol pro Liter oder Gramm pro ml usw., viel bequemer austauschen können.
-
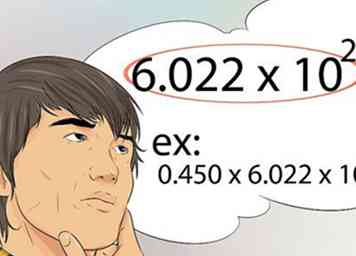 9 Wissen, wie man Avogadros Nummer benutzt. Dies ist die Zahl, die die Anzahl der Moleküle, Atome oder Teilchen in einem Mol darstellt. Avogrados Nummer ist 6.022x10 23.[39]
9 Wissen, wie man Avogadros Nummer benutzt. Dies ist die Zahl, die die Anzahl der Moleküle, Atome oder Teilchen in einem Mol darstellt. Avogrados Nummer ist 6.022x10 23.[39] - Zum Beispiel enthalten 0,450 Mole Fe wie viele Atome? Die Antwort ist 0,450 x 6,022 x 10 23.[40]
-
 10 Denk an Karotten. Wenn Sie Schwierigkeiten haben zu verstehen, wie Sie die Avogadro-Nummer anwenden, denken Sie an Karotten anstelle von Atomen, Molekülen oder Partikeln. Wie viele Karotten gibt es in einem Dutzend? Nun, du weißt, dass ein Dutzend 12 von etwas enthält, also gibt es 12 Karotten in einem Dutzend.
10 Denk an Karotten. Wenn Sie Schwierigkeiten haben zu verstehen, wie Sie die Avogadro-Nummer anwenden, denken Sie an Karotten anstelle von Atomen, Molekülen oder Partikeln. Wie viele Karotten gibt es in einem Dutzend? Nun, du weißt, dass ein Dutzend 12 von etwas enthält, also gibt es 12 Karotten in einem Dutzend. - Beantworten Sie nun die Frage, wie viele Karotten in einem Maulwurf sind? Anstatt mit 12 zu multiplizieren, verwenden Sie die Avogadro-Nummer mehrfach. So gibt es 6.022 x 1023 Karotten in einem Maulwurf.
- Die Avogadro-Zahl wird verwendet, um irgendetwas von der Substanz, ein Atom, ein Molekül, ein Teilchen oder eine Karotte, zu konvertieren, um zu bestimmen, wie viele davon in einem Maulwurf enthalten sind.
- Wenn Sie die Anzahl der Mole von etwas wissen, ist der Endwert für die Anzahl der vorhandenen Moleküle, Atome oder Teilchen die Zahl, die die Zahl von Avogrado ist.[41]
- Zu verstehen, wie man Teilchen in Mole umwandelt, ist ein wichtiger Teil der Chemie. Molare Umrechnungen sind ein Teil der Berechnung von Verhältnissen und Proportionen. Das bedeutet die Menge von etwas in Mol als Teil von etwas anderem.
-
 11 Konzentriere dich darauf, die Molarität zu verstehen. Betrachte die Anzahl der Mole von etwas, das in einer flüssigen Umgebung enthalten ist. Dieses Beispiel ist wichtig, um es zu verstehen, da wir jetzt über Molarität sprechen, oder den Anteil von etwas, ausgedrückt als Mol pro Liter.
11 Konzentriere dich darauf, die Molarität zu verstehen. Betrachte die Anzahl der Mole von etwas, das in einer flüssigen Umgebung enthalten ist. Dieses Beispiel ist wichtig, um es zu verstehen, da wir jetzt über Molarität sprechen, oder den Anteil von etwas, ausgedrückt als Mol pro Liter. - Molarität wird üblicherweise in der Chemie verwendet, um die Menge von etwas in einer flüssigen Umgebung oder die Menge eines in einer flüssigen Lösung enthaltenen gelösten Stoffes auszudrücken. Die Molarität wird berechnet, indem die Mole gelöster Stoffe durch die Liter Lösung dividiert werden. Die Molarität wird als Mol pro Liter ausgedrückt.[42]
- Dichte berechnen Die Dichte ist auch eine häufig verwendete Maßnahme in der Chemie. Die Dichte ist das Maß für die Masse pro Volumeneinheit einer chemischen Substanz. Der gebräuchlichste Ausdruck für die Dichte ist in Gramm pro Milliliter oder Gramm pro Kubikzentimeter angegeben, was dasselbe ist.[43]
-
 12 Konvertiere Gleichungen in ihre empirische Formel. Dies bedeutet, dass endgültige Antworten für Gleichungen als falsch angesehen werden, es sei denn, Sie haben sie auf ihre einfachste Form zerlegt.[44]
12 Konvertiere Gleichungen in ihre empirische Formel. Dies bedeutet, dass endgültige Antworten für Gleichungen als falsch angesehen werden, es sei denn, Sie haben sie auf ihre einfachste Form zerlegt.[44] - Dies gilt nicht für molekulare Formeln, da diese Art von Beschreibung Ihnen die genauen Anteile der chemischen Elemente, aus denen das Molekül besteht, anzeigt.[45]
-
 13 Wissen, was in einer molekularen Formel enthalten ist. Sie ändern eine molekulare Formel nicht in ihre einfachste oder empirische Form, weil die molekulare Formel Ihnen genau sagt, was das Molekül ausmacht.
13 Wissen, was in einer molekularen Formel enthalten ist. Sie ändern eine molekulare Formel nicht in ihre einfachste oder empirische Form, weil die molekulare Formel Ihnen genau sagt, was das Molekül ausmacht. - Eine molekulare Formel wird in einer Sprache geschrieben, die die Abkürzung der Elemente verwendet, und wie viele Atome jedes Elements das Molekül bilden.
- Zum Beispiel ist die molekulare Formel für Wasser H2O. Dies bedeutet, dass jedes Wassermolekül 2 Wasserstoffatome und 1 Sauerstoffatom enthält. Die molekulare Formel für Acetaminophen ist C8H9NO2. Jede chemische Verbindung wird durch ihre molekulare Formel dargestellt.
-
 14 Betrachten Sie die Chemie Mathematik als Stöchiometrie. Sie werden wahrscheinlich auf diesen Begriff stoßen. Es ist eine Beschreibung der Art, wie Chemie mit mathematischen Formeln ausgedrückt wird. Unter Verwendung von chemischer Mathematik oder Stöchiometrie werden die Werte von Elementen und chemischen Verbindungen oft in Mol, Molprozent, Mol pro Liter oder Mol pro kg dargestellt.[46]
14 Betrachten Sie die Chemie Mathematik als Stöchiometrie. Sie werden wahrscheinlich auf diesen Begriff stoßen. Es ist eine Beschreibung der Art, wie Chemie mit mathematischen Formeln ausgedrückt wird. Unter Verwendung von chemischer Mathematik oder Stöchiometrie werden die Werte von Elementen und chemischen Verbindungen oft in Mol, Molprozent, Mol pro Liter oder Mol pro kg dargestellt.[46] - Als eine allgemeine mathematische Prozedur müssen Sie Gramm in Mol umwandeln. Die atomare Masseneinheit eines Elements in Gramm entspricht einem Mol dieser Substanz. Zum Beispiel hat Calcium eine Masse von 40 atomaren Masseneinheiten. Daher entsprechen 40 Gramm Calcium einem Mol Calcium.[47]
-
 15 Fragen Sie nach weiteren Beispielen. Wenn die mathematischen Gleichungen und Konvertierungen nicht leicht für Sie kommen, sprechen Sie mit Ihrem Lehrer oder Professor. Bitten Sie um weitere Probleme, die Sie selbständig bearbeiten können, bis die beteiligten Konzepte und alle Faktoren der Konversion für Sie sinnvoll sind.
15 Fragen Sie nach weiteren Beispielen. Wenn die mathematischen Gleichungen und Konvertierungen nicht leicht für Sie kommen, sprechen Sie mit Ihrem Lehrer oder Professor. Bitten Sie um weitere Probleme, die Sie selbständig bearbeiten können, bis die beteiligten Konzepte und alle Faktoren der Konversion für Sie sinnvoll sind.
Teil Sieben von Acht:
Gute Lerngewohnheiten entwickeln
-
 1 Bilden Sie oder treten Sie einer Lerngruppe bei. Sei dir nicht peinlich, wenn Chemie dir schwer fällt. Es ist ein schwieriges Thema für fast jeden.
1 Bilden Sie oder treten Sie einer Lerngruppe bei. Sei dir nicht peinlich, wenn Chemie dir schwer fällt. Es ist ein schwieriges Thema für fast jeden. - Durch die Arbeit in Gruppen werden einige Mitglieder Bereiche leichter finden als andere und können dabei helfen, ihre Lernmethoden mit der Gruppe zu teilen. Teilen und erobern.
-
 2 Lesen Sie alle Kapitel in Ihrem Chemie-Lehrbuch. Ein Chemiebuch zu lesen ist nicht immer das interessanteste Buch im Regal. Aber nehmen Sie sich die Zeit, die zugewiesenen Abschnitte zu lesen, und markieren Sie die Teile, die einfach keinen Sinn ergeben. Versuchen Sie, eine Liste von Fragen oder Konzepten zu erstellen, die Sie nicht verstehen können.
2 Lesen Sie alle Kapitel in Ihrem Chemie-Lehrbuch. Ein Chemiebuch zu lesen ist nicht immer das interessanteste Buch im Regal. Aber nehmen Sie sich die Zeit, die zugewiesenen Abschnitte zu lesen, und markieren Sie die Teile, die einfach keinen Sinn ergeben. Versuchen Sie, eine Liste von Fragen oder Konzepten zu erstellen, die Sie nicht verstehen können. - Gehen Sie später zu diesen Teilen zurück und schauen Sie sich etwas genauer um. Wenn sie immer noch verwirrend erscheinen, sprechen Sie mit Ihrer Lerngruppe, Ihrem Professor oder einer Lehrkraft.
- Versuchen Sie, die Fragen am Ende des Kapitels zu beantworten. Die meisten Lehrbücher bieten zusätzliche Informationen, die die richtigen Antworten erklären, falls etwas für Sie verwirrend ist.
- Lehrbücher verwenden visuelle Hilfsmittel, um die wichtigsten Lehrpunkte zu vermitteln. Schau dir die Visuals an und achte auf die Bildunterschriften. Dies kann helfen, etwas Verwirrung zu beseitigen.
-
 3 Bitten Sie um Erlaubnis, die Vorträge aufzuzeichnen. Sich Notizen zu machen und alles zu sehen, was der Lehrer auf Brettern oder Overheads schreibt, ist schwer zu machen, besonders in einem schwierigen Fach wie der Chemie. Eine Aufnahme, die Sie immer wieder anhören können, erleichtert Ihnen das Verständnis. Sie sollten jedoch immer die Erlaubnis einholen, die Vorlesungen aufzuzeichnen, bevor Sie dies tun.
3 Bitten Sie um Erlaubnis, die Vorträge aufzuzeichnen. Sich Notizen zu machen und alles zu sehen, was der Lehrer auf Brettern oder Overheads schreibt, ist schwer zu machen, besonders in einem schwierigen Fach wie der Chemie. Eine Aufnahme, die Sie immer wieder anhören können, erleichtert Ihnen das Verständnis. Sie sollten jedoch immer die Erlaubnis einholen, die Vorlesungen aufzuzeichnen, bevor Sie dies tun. - Versuche etwas zu sagen wie: "Ich finde es leichter zu lernen, wenn ich den Vortrag noch einmal hören kann, während ich meine Notizen durchlese. Wäre es in Ordnung, wenn ich deine Vorlesungen aufzeichne, damit ich das machen kann? "
-
 4 Greifen Sie auf alte Tests oder Lernhilfen zu. Die meisten naturwissenschaftlichen Kurse, z. B. die Chemie, bieten Zugang zu früheren Testfragen, um den Schülern die Vorbereitung auf wichtige Tests zu erleichtern.
4 Greifen Sie auf alte Tests oder Lernhilfen zu. Die meisten naturwissenschaftlichen Kurse, z. B. die Chemie, bieten Zugang zu früheren Testfragen, um den Schülern die Vorbereitung auf wichtige Tests zu erleichtern. - Vermeide es, die Antworten nur auswendig zu lernen. Chemie ist ein Fach, das Sie verstehen müssen, um dieselbe Frage zu beantworten, wenn sie anders formuliert wäre.
Teil Acht von Acht:
Hilfe bekommen
-
 1 Lernen Sie Ihren Professor oder Lehrer kennen. Um die Chemie mit der bestmöglichen Note zu belegen, nehmen Sie sich Zeit, um die Person zu treffen, die die Klasse unterrichtet. Wenn Sie Schwierigkeiten haben, lassen Sie sie wissen, dass dies schwierig für Sie ist. Aber auch wenn es Ihnen gut geht, ist es eine gute Idee, den Professor kennenzulernen.
1 Lernen Sie Ihren Professor oder Lehrer kennen. Um die Chemie mit der bestmöglichen Note zu belegen, nehmen Sie sich Zeit, um die Person zu treffen, die die Klasse unterrichtet. Wenn Sie Schwierigkeiten haben, lassen Sie sie wissen, dass dies schwierig für Sie ist. Aber auch wenn es Ihnen gut geht, ist es eine gute Idee, den Professor kennenzulernen. - Viele Professoren haben Studienführer zur Verfügung und öffnen zusätzliche Bürozeiten für die Hilfe von Studenten bei Bedarf.
- Führen Sie eine Liste von Bereichen auf, die schwierig sind, und bitten Sie Ihren Professor oder Lehrer um Hilfe. Dies gibt Ihnen die Möglichkeit, die schwierigen Themen zu verstehen, bevor die Klasse zum nächsten Abschnitt übergeht, und Sie werden noch verwirrter.
-
 2 Besuchen Sie die Onlinehilfsmittel. Achten Sie auf Online-Ressourcen oder Links, die von der Chemieabteilung Ihrer eigenen Schule zur Verfügung gestellt werden.
2 Besuchen Sie die Onlinehilfsmittel. Achten Sie auf Online-Ressourcen oder Links, die von der Chemieabteilung Ihrer eigenen Schule zur Verfügung gestellt werden. -
 3 Versuchen Sie, nicht überwältigt zu werden. Die detaillierte Information über die verschiedenen Arten von chemischen Reaktionen, das Teilen von Elektronen, das Ändern der Ladung eines Elements oder einer Verbindung und das Wissen, was die verschiedenen Arten von Reaktionen tun, kann sehr verwirrend sein.
3 Versuchen Sie, nicht überwältigt zu werden. Die detaillierte Information über die verschiedenen Arten von chemischen Reaktionen, das Teilen von Elektronen, das Ändern der Ladung eines Elements oder einer Verbindung und das Wissen, was die verschiedenen Arten von Reaktionen tun, kann sehr verwirrend sein. - Unterteilen Sie Bereiche, die schwierig in beschreibbare Begriffe sind. Zum Beispiel können Sie verbalisieren, dass Sie Oxidationsreaktionen nicht verstehen oder Elemente mit positiven und negativen Ladungen kombinieren. Wenn Sie die Bereiche, in denen Sie Schwierigkeiten haben zu verstehen, verbalisieren, können Sie auch eine gewisse Beruhigung feststellen, wenn Sie feststellen, dass Sie viel gelernt und verstanden haben.
Facebook
Twitter
Google+
 Minotauromaquia
Minotauromaquia
 1 Beginnen Sie mit den grundlegendsten Strukturen. Um deinen Chemieunterricht zu bestehen, musst du die Bausteine gut verstehen, die alles ausmachen, was Substanz oder Masse hat.
1 Beginnen Sie mit den grundlegendsten Strukturen. Um deinen Chemieunterricht zu bestehen, musst du die Bausteine gut verstehen, die alles ausmachen, was Substanz oder Masse hat.  2 Fassen Sie das Konzept eines Atoms. Ein Atom gilt als der kleinste Baustein von allem, was Masse hat, einschließlich Dinge, die wir nicht immer sehen können, wie Gase. Aber selbst das winzige Atom hat noch kleinere Teile, die seine Struktur ausmachen.[1]
2 Fassen Sie das Konzept eines Atoms. Ein Atom gilt als der kleinste Baustein von allem, was Masse hat, einschließlich Dinge, die wir nicht immer sehen können, wie Gase. Aber selbst das winzige Atom hat noch kleinere Teile, die seine Struktur ausmachen.[1]  3 Verstehen Sie den atomaren Rahmen eines Elements. Ein Element wird als eine Substanz in der Natur angesehen, die nicht in irgendein anderes Element oder andere einfachere Formen zerlegt werden kann. Elemente bestehen aus Atomen.[4]
3 Verstehen Sie den atomaren Rahmen eines Elements. Ein Element wird als eine Substanz in der Natur angesehen, die nicht in irgendein anderes Element oder andere einfachere Formen zerlegt werden kann. Elemente bestehen aus Atomen.[4]  4 Versteht mehr über den Nukleus. Die im Kern vorhandenen Neutronen sind neutral geladen. Protonen haben eine positive Ladung. Die Ordnungszahl eines Elements ist genau die gleiche wie die Anzahl der Protonen im Kern.[6]
4 Versteht mehr über den Nukleus. Die im Kern vorhandenen Neutronen sind neutral geladen. Protonen haben eine positive Ladung. Die Ordnungszahl eines Elements ist genau die gleiche wie die Anzahl der Protonen im Kern.[6]  5 Erkennen Sie Lewis-Diagramme. Lewis-Diagramme werden manchmal Elektron-Punkt-Diagramme genannt. Dies sind einfache Diagramme, die Punkte zur Darstellung der gepaarten und ungepaarten Elektronen in der äußeren Schale eines Atoms verwenden.[7]
5 Erkennen Sie Lewis-Diagramme. Lewis-Diagramme werden manchmal Elektron-Punkt-Diagramme genannt. Dies sind einfache Diagramme, die Punkte zur Darstellung der gepaarten und ungepaarten Elektronen in der äußeren Schale eines Atoms verwenden.[7]  6 Wissen Sie, was die Oktettregel bedeutet. Lewis-Diagramme arbeiten nach der Oktettregel, die besagt, dass Atome stabil sind, wenn sie Zugang zu acht Elektronen in der äußeren Schale haben. Wasserstoff ist die Ausnahme und gilt als stabil mit zwei Elektronen in der äußeren Schale.[9]
6 Wissen Sie, was die Oktettregel bedeutet. Lewis-Diagramme arbeiten nach der Oktettregel, die besagt, dass Atome stabil sind, wenn sie Zugang zu acht Elektronen in der äußeren Schale haben. Wasserstoff ist die Ausnahme und gilt als stabil mit zwei Elektronen in der äußeren Schale.[9]  7 Zeichnen Sie ein Lewis-Diagramm. Das Symbol für ein Element, umgeben von einer Anordnung von Punkten, ist ein Lewis-Diagramm. Stellen Sie sich das Diagramm als Standbild eines Films vor. Anstatt der Elektronen, die um die Außenseite des Elements wirbeln, werden sie als ein fester Zeitpunkt dargestellt.[10]
7 Zeichnen Sie ein Lewis-Diagramm. Das Symbol für ein Element, umgeben von einer Anordnung von Punkten, ist ein Lewis-Diagramm. Stellen Sie sich das Diagramm als Standbild eines Films vor. Anstatt der Elektronen, die um die Außenseite des Elements wirbeln, werden sie als ein fester Zeitpunkt dargestellt.[10]  8 Verstehen Sie die Anordnung von Elektronen, wie sie Elemente miteinander verbinden. Die Lewis-Diagramme sind eine vereinfachte visuelle Darstellung dessen, was unter chemischen Bindungen verstanden wird.
8 Verstehen Sie die Anordnung von Elektronen, wie sie Elemente miteinander verbinden. Die Lewis-Diagramme sind eine vereinfachte visuelle Darstellung dessen, was unter chemischen Bindungen verstanden wird.  1 Schau dir das Periodensystem an. Wenn Sie Probleme mit den Eigenschaften von Elementen haben, sollten Sie einige Zeit damit verbringen, das verfügbare Material im Periodensystem zu überprüfen. Am wichtigsten, schauen Sie sich genau einen an.
1 Schau dir das Periodensystem an. Wenn Sie Probleme mit den Eigenschaften von Elementen haben, sollten Sie einige Zeit damit verbringen, das verfügbare Material im Periodensystem zu überprüfen. Am wichtigsten, schauen Sie sich genau einen an.  4 Finde die atomare Masse jedes Elements. Die Zahl unten ist die atomare Masse. Denken Sie daran, dass die Anzahl der Protonen in Kombination mit der Anzahl der Neutronen, die im Kern gefunden werden, gleich der Atommasse ist.[14]
4 Finde die atomare Masse jedes Elements. Die Zahl unten ist die atomare Masse. Denken Sie daran, dass die Anzahl der Protonen in Kombination mit der Anzahl der Neutronen, die im Kern gefunden werden, gleich der Atommasse ist.[14]  5 Berechnen Sie die Anzahl der im Kern gefundenen Neutronen. Sie können die Zahlen aus dem Periodensystem verwenden, um dies herauszufinden. Die Ordnungszahl für jedes Element ist genau die gleiche wie die Anzahl der Protonen im Kern.
5 Berechnen Sie die Anzahl der im Kern gefundenen Neutronen. Sie können die Zahlen aus dem Periodensystem verwenden, um dies herauszufinden. Die Ordnungszahl für jedes Element ist genau die gleiche wie die Anzahl der Protonen im Kern.  6 Finde die Anzahl der Elektronen heraus. Denken Sie daran, dass Gegensätze anziehen. Elektronen sind positiv geladene Teilchen, die um den Kern eines Atoms fliegen wie Planeten, die die Sonne umkreisen. Die Anzahl der negativ geladenen Elektronen, die zum Kern gezogen werden, hängt von der Anzahl der positiv geladenen Protonen im Kern ab.
6 Finde die Anzahl der Elektronen heraus. Denken Sie daran, dass Gegensätze anziehen. Elektronen sind positiv geladene Teilchen, die um den Kern eines Atoms fliegen wie Planeten, die die Sonne umkreisen. Die Anzahl der negativ geladenen Elektronen, die zum Kern gezogen werden, hängt von der Anzahl der positiv geladenen Protonen im Kern ab.  1 Balance eine chemische Gleichung. In einem Chemieunterricht wird erwartet, dass Sie wissen, wie Sie vorhersagen können, was passiert, wenn Elemente kombiniert werden. Auf dem Papier wird dies als Ausgleich chemischer Gleichungen bezeichnet.[17]
1 Balance eine chemische Gleichung. In einem Chemieunterricht wird erwartet, dass Sie wissen, wie Sie vorhersagen können, was passiert, wenn Elemente kombiniert werden. Auf dem Papier wird dies als Ausgleich chemischer Gleichungen bezeichnet.[17]  2 Denken Sie über die Gleichungen anders nach. Wenn Sie Probleme beim Ausgleichen von chemischen Gleichungen haben, denken Sie über die Gleichung als Teil eines Rezepts nach, das jedoch auf beiden Seiten angepasst werden muss, damit Sie weniger aus Ihrem Rezept machen können.
2 Denken Sie über die Gleichungen anders nach. Wenn Sie Probleme beim Ausgleichen von chemischen Gleichungen haben, denken Sie über die Gleichung als Teil eines Rezepts nach, das jedoch auf beiden Seiten angepasst werden muss, damit Sie weniger aus Ihrem Rezept machen können. 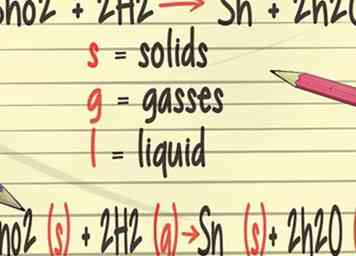 3 Fügen Sie Ihren ausgeglichenen Gleichungen mehr Details hinzu. In deinem Chemieunterricht lernst du, Symbole zu deinen ausgeglichenen Gleichungen hinzuzufügen, die den physikalischen Zustand der Elemente darstellen. Diese Symbole umfassen (s) für Feststoffe, (g) für Gase und (l) für Flüssigkeiten.[21]
3 Fügen Sie Ihren ausgeglichenen Gleichungen mehr Details hinzu. In deinem Chemieunterricht lernst du, Symbole zu deinen ausgeglichenen Gleichungen hinzuzufügen, die den physikalischen Zustand der Elemente darstellen. Diese Symbole umfassen (s) für Feststoffe, (g) für Gase und (l) für Flüssigkeiten.[21]  4 Identifizieren Sie Veränderungen, die bei einer chemischen Reaktion auftreten. Chemische Reaktionen beginnen mit den Grundelementen oder bereits kombinierten Elementen, die Reaktanten genannt werden. Die Kombination von zwei oder mehr Reaktanten zusammen ergibt ein einzelnes Produkt oder mehrere Produkte.
4 Identifizieren Sie Veränderungen, die bei einer chemischen Reaktion auftreten. Chemische Reaktionen beginnen mit den Grundelementen oder bereits kombinierten Elementen, die Reaktanten genannt werden. Die Kombination von zwei oder mehr Reaktanten zusammen ergibt ein einzelnes Produkt oder mehrere Produkte.  1 Erkennen Sie die Arten von Reaktionen. Chemische Reaktionen können als Ergebnis vieler Einflüsse auftreten, zusätzlich zur einfachen Kombination von Inhaltsstoffen.
1 Erkennen Sie die Arten von Reaktionen. Chemische Reaktionen können als Ergebnis vieler Einflüsse auftreten, zusätzlich zur einfachen Kombination von Inhaltsstoffen.  2 Verwenden Sie die bereitgestellten Ressourcen. Sie müssen die Unterschiede in jeder Art von Reaktion erfassen, die in Ihrer Klasse behandelt werden. Verwenden Sie Ressourcen, die Ihnen von Ihrem Lehrer oder Professor zur Verfügung gestellt wurden, um die verschiedenen Reaktionstypen in Ihrer Klasse zu verstehen. Haben Sie keine Angst, Fragen zu stellen.
2 Verwenden Sie die bereitgestellten Ressourcen. Sie müssen die Unterschiede in jeder Art von Reaktion erfassen, die in Ihrer Klasse behandelt werden. Verwenden Sie Ressourcen, die Ihnen von Ihrem Lehrer oder Professor zur Verfügung gestellt wurden, um die verschiedenen Reaktionstypen in Ihrer Klasse zu verstehen. Haben Sie keine Angst, Fragen zu stellen.  3 Denken Sie über chemische Reaktionen logisch nach. Versuchen Sie, es nicht schwerer zu machen, als es bereits ist, indem Sie sich in der Terminologie verfangen.Bei den Arten chemischer Reaktionen, die Sie lernen werden, müssen Sie einfach etwas tun, um etwas zu verändern.
3 Denken Sie über chemische Reaktionen logisch nach. Versuchen Sie, es nicht schwerer zu machen, als es bereits ist, indem Sie sich in der Terminologie verfangen.Bei den Arten chemischer Reaktionen, die Sie lernen werden, müssen Sie einfach etwas tun, um etwas zu verändern.  1 Erfahren Sie, wie Verbindungen benannt werden. Die Chemie hat ihre eigenen Regeln für die Nomenklatur. Die Arten von Reaktionen, die chemischen Verbindungen passieren, der Verlust oder Gewinn von Elektronen in ihrer äußeren Hülle und die Stabilität oder Instabilität von Verbindungen sind Teil der chemischen Nomenklatur.
1 Erfahren Sie, wie Verbindungen benannt werden. Die Chemie hat ihre eigenen Regeln für die Nomenklatur. Die Arten von Reaktionen, die chemischen Verbindungen passieren, der Verlust oder Gewinn von Elektronen in ihrer äußeren Hülle und die Stabilität oder Instabilität von Verbindungen sind Teil der chemischen Nomenklatur.  2 Nehmen Sie den Abschnitt über die Nomenklatur ernst. Die meisten Anfänger-Chemie-Klassen haben einen Abschnitt, der nur der Nomenklatur gewidmet ist. In einigen Schulen bedeutet das Versäumnis, den Nomenklatur-Teil der Klasse zu bestehen, das Scheitern der Klasse.
2 Nehmen Sie den Abschnitt über die Nomenklatur ernst. Die meisten Anfänger-Chemie-Klassen haben einen Abschnitt, der nur der Nomenklatur gewidmet ist. In einigen Schulen bedeutet das Versäumnis, den Nomenklatur-Teil der Klasse zu bestehen, das Scheitern der Klasse. 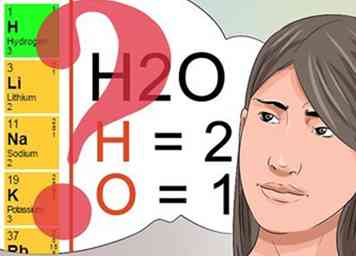 3 Wissen, was hochgestellte und tiefgestellte Zahlen anzeigen. Zu verstehen, was hochgestellte und tiefgestellte Zahlen bedeuten, ist entscheidend für das Bestehen des Chemieunterrichts.[24]
3 Wissen, was hochgestellte und tiefgestellte Zahlen anzeigen. Zu verstehen, was hochgestellte und tiefgestellte Zahlen bedeuten, ist entscheidend für das Bestehen des Chemieunterrichts.[24]  4 Erkenne, wie Atome miteinander reagieren. Ein Teil der in der Chemie verwendeten Nomenklatur beinhaltet spezifische Regeln für die Benennung der Produkte aus bestimmten Arten von Reaktionen.[25]
4 Erkenne, wie Atome miteinander reagieren. Ein Teil der in der Chemie verwendeten Nomenklatur beinhaltet spezifische Regeln für die Benennung der Produkte aus bestimmten Arten von Reaktionen.[25]  5 Erkenne, dass Indizes die Formel für eine stabile Ladung einer Verbindung anzeigen können. Wissenschaftler verwenden Subskripte, um die endgültige molekulare Formel einer Verbindung zu identifizieren, die auch eine stabile Verbindung mit einer neutralen Ladung anzeigt.
5 Erkenne, dass Indizes die Formel für eine stabile Ladung einer Verbindung anzeigen können. Wissenschaftler verwenden Subskripte, um die endgültige molekulare Formel einer Verbindung zu identifizieren, die auch eine stabile Verbindung mit einer neutralen Ladung anzeigt.  6 Identifizieren Sie Anionen und Kationen anhand ihrer Position im Periodensystem. Die Elemente des Periodensystems, die in die erste Spalte der Elemente fallen, werden als Alkalien betrachtet und bilden +1 Kationenladungen. Zum Beispiel Na + und Li +.[30]
6 Identifizieren Sie Anionen und Kationen anhand ihrer Position im Periodensystem. Die Elemente des Periodensystems, die in die erste Spalte der Elemente fallen, werden als Alkalien betrachtet und bilden +1 Kationenladungen. Zum Beispiel Na + und Li +.[30]  7 Lerne die allgemeineren Anionen und Kationen zu erkennen. Um Ihnen zu helfen, Ihren Chemieunterricht zu bestehen, sollten Sie sich so gut wie möglich mit der Nomenklatur vertraut machen, die an Elementgruppen gebunden ist. Diese Art von Hochschrift ändert sich nicht.[33]
7 Lerne die allgemeineren Anionen und Kationen zu erkennen. Um Ihnen zu helfen, Ihren Chemieunterricht zu bestehen, sollten Sie sich so gut wie möglich mit der Nomenklatur vertraut machen, die an Elementgruppen gebunden ist. Diese Art von Hochschrift ändert sich nicht.[33]  8 Stellen Sie sich Chemie als eine neue Sprache vor. Verstehen Sie, dass die geschriebenen Formen der Anzeige von Ladungen, die Anzahl der Atome in einem Molekül und die Bindungen, die gebildet werden, um Moleküle zusammenzuhalten, alle Teil der Sprache der Chemie sind. All dies ist eine schriftliche Art zu repräsentieren, was in den chemischen Reaktionen passiert, die nicht wirklich gesehen werden können.
8 Stellen Sie sich Chemie als eine neue Sprache vor. Verstehen Sie, dass die geschriebenen Formen der Anzeige von Ladungen, die Anzahl der Atome in einem Molekül und die Bindungen, die gebildet werden, um Moleküle zusammenzuhalten, alle Teil der Sprache der Chemie sind. All dies ist eine schriftliche Art zu repräsentieren, was in den chemischen Reaktionen passiert, die nicht wirklich gesehen werden können.  1 Kennen Sie die Reihenfolge für grundlegende mathematische Berechnungen. In der Chemie werden manchmal sehr detaillierte Berechnungen benötigt, aber zu anderen Zeiten sind nur grundlegende mathematische Fähigkeiten ausreichend. Es ist wichtig, die richtige Reihenfolge für das Ausführen von Berechnungen in einer Gleichung zu verstehen.[35]
1 Kennen Sie die Reihenfolge für grundlegende mathematische Berechnungen. In der Chemie werden manchmal sehr detaillierte Berechnungen benötigt, aber zu anderen Zeiten sind nur grundlegende mathematische Fähigkeiten ausreichend. Es ist wichtig, die richtige Reihenfolge für das Ausführen von Berechnungen in einer Gleichung zu verstehen.[35]  2 Machen Sie es sich bequem, sehr große Zahlen zu runden. Während das Runden von Zahlen nicht für die Chemie einzigartig ist, führen die Antworten auf einige der komplexen mathematischen Gleichungen zu Zahlen, die zu lang zum Schreiben sind. Achten Sie genau auf die Anweisungen, die Sie beim Runden Ihrer Antworten erhalten.[36]
2 Machen Sie es sich bequem, sehr große Zahlen zu runden. Während das Runden von Zahlen nicht für die Chemie einzigartig ist, führen die Antworten auf einige der komplexen mathematischen Gleichungen zu Zahlen, die zu lang zum Schreiben sind. Achten Sie genau auf die Anweisungen, die Sie beim Runden Ihrer Antworten erhalten.[36]  3 Verstehen Sie den absoluten Wert. In der Chemie werden einige Zahlen als absoluter Wert und nicht als ihr tatsächlicher mathematischer Wert bezeichnet. Der absolute Wert ist der Abstand von der Zahl zu Null.
3 Verstehen Sie den absoluten Wert. In der Chemie werden einige Zahlen als absoluter Wert und nicht als ihr tatsächlicher mathematischer Wert bezeichnet. Der absolute Wert ist der Abstand von der Zahl zu Null.  4 Vertraut sein mit den akzeptierten Maßeinheiten. Hier sind ein paar Beispiele.
4 Vertraut sein mit den akzeptierten Maßeinheiten. Hier sind ein paar Beispiele.  5 Üben Sie die Umstellung von einer Maßeinheit auf eine andere. Ein Teil des Chemieunterrichts besteht darin, dass Sie Conversions von einer akzeptierten Skala in eine andere durchführen. Dies kann den Wechsel von einer Temperaturmessung zu einer anderen umfassen, wobei Pfund in Kilogramm und Unzen in Liter geändert werden.
5 Üben Sie die Umstellung von einer Maßeinheit auf eine andere. Ein Teil des Chemieunterrichts besteht darin, dass Sie Conversions von einer akzeptierten Skala in eine andere durchführen. Dies kann den Wechsel von einer Temperaturmessung zu einer anderen umfassen, wobei Pfund in Kilogramm und Unzen in Liter geändert werden.  6 Nimm dir Zeit zum Üben. Da Sie in Ihrer Klasse verschiedenen Conversions ausgesetzt sind, sollten Sie sich die Zeit nehmen, um zu lernen, wie Sie von einem zum anderen und wieder zurück konvertieren können.
6 Nimm dir Zeit zum Üben. Da Sie in Ihrer Klasse verschiedenen Conversions ausgesetzt sind, sollten Sie sich die Zeit nehmen, um zu lernen, wie Sie von einem zum anderen und wieder zurück konvertieren können.  7 Wissen, wie man Konzentrationen berechnet. Schärfen Sie Ihre grundlegenden mathematischen Fähigkeiten in den Bereichen Prozentsätze, Verhältnisse und Proportionen.
7 Wissen, wie man Konzentrationen berechnet. Schärfen Sie Ihre grundlegenden mathematischen Fähigkeiten in den Bereichen Prozentsätze, Verhältnisse und Proportionen.  8 Üben Sie mit Nährwertkennzeichnungen auf Lebensmitteln. Um die Chemie zu bestehen, müssen Sie bequem sein, Verhältnisse, Proportionen, Prozentsätze und dann wieder zurück zu berechnen. Wenn dies für Sie schwierig ist, sollten Sie andere gebräuchliche Maßeinheiten verwenden, wie z. B. auf Lebensmitteletiketten.
8 Üben Sie mit Nährwertkennzeichnungen auf Lebensmitteln. Um die Chemie zu bestehen, müssen Sie bequem sein, Verhältnisse, Proportionen, Prozentsätze und dann wieder zurück zu berechnen. Wenn dies für Sie schwierig ist, sollten Sie andere gebräuchliche Maßeinheiten verwenden, wie z. B. auf Lebensmitteletiketten. 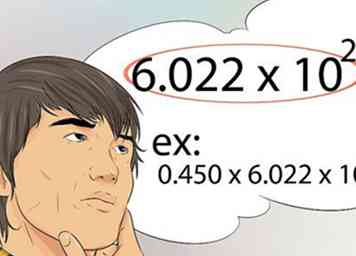 9 Wissen, wie man Avogadros Nummer benutzt. Dies ist die Zahl, die die Anzahl der Moleküle, Atome oder Teilchen in einem Mol darstellt. Avogrados Nummer ist 6.022x10 23.[39]
9 Wissen, wie man Avogadros Nummer benutzt. Dies ist die Zahl, die die Anzahl der Moleküle, Atome oder Teilchen in einem Mol darstellt. Avogrados Nummer ist 6.022x10 23.[39]  10 Denk an Karotten. Wenn Sie Schwierigkeiten haben zu verstehen, wie Sie die Avogadro-Nummer anwenden, denken Sie an Karotten anstelle von Atomen, Molekülen oder Partikeln. Wie viele Karotten gibt es in einem Dutzend? Nun, du weißt, dass ein Dutzend 12 von etwas enthält, also gibt es 12 Karotten in einem Dutzend.
10 Denk an Karotten. Wenn Sie Schwierigkeiten haben zu verstehen, wie Sie die Avogadro-Nummer anwenden, denken Sie an Karotten anstelle von Atomen, Molekülen oder Partikeln. Wie viele Karotten gibt es in einem Dutzend? Nun, du weißt, dass ein Dutzend 12 von etwas enthält, also gibt es 12 Karotten in einem Dutzend.  11 Konzentriere dich darauf, die Molarität zu verstehen. Betrachte die Anzahl der Mole von etwas, das in einer flüssigen Umgebung enthalten ist. Dieses Beispiel ist wichtig, um es zu verstehen, da wir jetzt über Molarität sprechen, oder den Anteil von etwas, ausgedrückt als Mol pro Liter.
11 Konzentriere dich darauf, die Molarität zu verstehen. Betrachte die Anzahl der Mole von etwas, das in einer flüssigen Umgebung enthalten ist. Dieses Beispiel ist wichtig, um es zu verstehen, da wir jetzt über Molarität sprechen, oder den Anteil von etwas, ausgedrückt als Mol pro Liter.  12 Konvertiere Gleichungen in ihre empirische Formel. Dies bedeutet, dass endgültige Antworten für Gleichungen als falsch angesehen werden, es sei denn, Sie haben sie auf ihre einfachste Form zerlegt.[44]
12 Konvertiere Gleichungen in ihre empirische Formel. Dies bedeutet, dass endgültige Antworten für Gleichungen als falsch angesehen werden, es sei denn, Sie haben sie auf ihre einfachste Form zerlegt.[44]  13 Wissen, was in einer molekularen Formel enthalten ist. Sie ändern eine molekulare Formel nicht in ihre einfachste oder empirische Form, weil die molekulare Formel Ihnen genau sagt, was das Molekül ausmacht.
13 Wissen, was in einer molekularen Formel enthalten ist. Sie ändern eine molekulare Formel nicht in ihre einfachste oder empirische Form, weil die molekulare Formel Ihnen genau sagt, was das Molekül ausmacht.  14 Betrachten Sie die Chemie Mathematik als Stöchiometrie. Sie werden wahrscheinlich auf diesen Begriff stoßen. Es ist eine Beschreibung der Art, wie Chemie mit mathematischen Formeln ausgedrückt wird. Unter Verwendung von chemischer Mathematik oder Stöchiometrie werden die Werte von Elementen und chemischen Verbindungen oft in Mol, Molprozent, Mol pro Liter oder Mol pro kg dargestellt.[46]
14 Betrachten Sie die Chemie Mathematik als Stöchiometrie. Sie werden wahrscheinlich auf diesen Begriff stoßen. Es ist eine Beschreibung der Art, wie Chemie mit mathematischen Formeln ausgedrückt wird. Unter Verwendung von chemischer Mathematik oder Stöchiometrie werden die Werte von Elementen und chemischen Verbindungen oft in Mol, Molprozent, Mol pro Liter oder Mol pro kg dargestellt.[46]  15 Fragen Sie nach weiteren Beispielen. Wenn die mathematischen Gleichungen und Konvertierungen nicht leicht für Sie kommen, sprechen Sie mit Ihrem Lehrer oder Professor. Bitten Sie um weitere Probleme, die Sie selbständig bearbeiten können, bis die beteiligten Konzepte und alle Faktoren der Konversion für Sie sinnvoll sind.
15 Fragen Sie nach weiteren Beispielen. Wenn die mathematischen Gleichungen und Konvertierungen nicht leicht für Sie kommen, sprechen Sie mit Ihrem Lehrer oder Professor. Bitten Sie um weitere Probleme, die Sie selbständig bearbeiten können, bis die beteiligten Konzepte und alle Faktoren der Konversion für Sie sinnvoll sind.  1 Bilden Sie oder treten Sie einer Lerngruppe bei. Sei dir nicht peinlich, wenn Chemie dir schwer fällt. Es ist ein schwieriges Thema für fast jeden.
1 Bilden Sie oder treten Sie einer Lerngruppe bei. Sei dir nicht peinlich, wenn Chemie dir schwer fällt. Es ist ein schwieriges Thema für fast jeden.  2 Lesen Sie alle Kapitel in Ihrem Chemie-Lehrbuch. Ein Chemiebuch zu lesen ist nicht immer das interessanteste Buch im Regal. Aber nehmen Sie sich die Zeit, die zugewiesenen Abschnitte zu lesen, und markieren Sie die Teile, die einfach keinen Sinn ergeben. Versuchen Sie, eine Liste von Fragen oder Konzepten zu erstellen, die Sie nicht verstehen können.
2 Lesen Sie alle Kapitel in Ihrem Chemie-Lehrbuch. Ein Chemiebuch zu lesen ist nicht immer das interessanteste Buch im Regal. Aber nehmen Sie sich die Zeit, die zugewiesenen Abschnitte zu lesen, und markieren Sie die Teile, die einfach keinen Sinn ergeben. Versuchen Sie, eine Liste von Fragen oder Konzepten zu erstellen, die Sie nicht verstehen können.  3 Bitten Sie um Erlaubnis, die Vorträge aufzuzeichnen. Sich Notizen zu machen und alles zu sehen, was der Lehrer auf Brettern oder Overheads schreibt, ist schwer zu machen, besonders in einem schwierigen Fach wie der Chemie. Eine Aufnahme, die Sie immer wieder anhören können, erleichtert Ihnen das Verständnis. Sie sollten jedoch immer die Erlaubnis einholen, die Vorlesungen aufzuzeichnen, bevor Sie dies tun.
3 Bitten Sie um Erlaubnis, die Vorträge aufzuzeichnen. Sich Notizen zu machen und alles zu sehen, was der Lehrer auf Brettern oder Overheads schreibt, ist schwer zu machen, besonders in einem schwierigen Fach wie der Chemie. Eine Aufnahme, die Sie immer wieder anhören können, erleichtert Ihnen das Verständnis. Sie sollten jedoch immer die Erlaubnis einholen, die Vorlesungen aufzuzeichnen, bevor Sie dies tun.  4 Greifen Sie auf alte Tests oder Lernhilfen zu. Die meisten naturwissenschaftlichen Kurse, z. B. die Chemie, bieten Zugang zu früheren Testfragen, um den Schülern die Vorbereitung auf wichtige Tests zu erleichtern.
4 Greifen Sie auf alte Tests oder Lernhilfen zu. Die meisten naturwissenschaftlichen Kurse, z. B. die Chemie, bieten Zugang zu früheren Testfragen, um den Schülern die Vorbereitung auf wichtige Tests zu erleichtern.  1 Lernen Sie Ihren Professor oder Lehrer kennen. Um die Chemie mit der bestmöglichen Note zu belegen, nehmen Sie sich Zeit, um die Person zu treffen, die die Klasse unterrichtet. Wenn Sie Schwierigkeiten haben, lassen Sie sie wissen, dass dies schwierig für Sie ist. Aber auch wenn es Ihnen gut geht, ist es eine gute Idee, den Professor kennenzulernen.
1 Lernen Sie Ihren Professor oder Lehrer kennen. Um die Chemie mit der bestmöglichen Note zu belegen, nehmen Sie sich Zeit, um die Person zu treffen, die die Klasse unterrichtet. Wenn Sie Schwierigkeiten haben, lassen Sie sie wissen, dass dies schwierig für Sie ist. Aber auch wenn es Ihnen gut geht, ist es eine gute Idee, den Professor kennenzulernen.  2 Besuchen Sie die Onlinehilfsmittel. Achten Sie auf Online-Ressourcen oder Links, die von der Chemieabteilung Ihrer eigenen Schule zur Verfügung gestellt werden.
2 Besuchen Sie die Onlinehilfsmittel. Achten Sie auf Online-Ressourcen oder Links, die von der Chemieabteilung Ihrer eigenen Schule zur Verfügung gestellt werden.  3 Versuchen Sie, nicht überwältigt zu werden. Die detaillierte Information über die verschiedenen Arten von chemischen Reaktionen, das Teilen von Elektronen, das Ändern der Ladung eines Elements oder einer Verbindung und das Wissen, was die verschiedenen Arten von Reaktionen tun, kann sehr verwirrend sein.
3 Versuchen Sie, nicht überwältigt zu werden. Die detaillierte Information über die verschiedenen Arten von chemischen Reaktionen, das Teilen von Elektronen, das Ändern der Ladung eines Elements oder einer Verbindung und das Wissen, was die verschiedenen Arten von Reaktionen tun, kann sehr verwirrend sein.