Wenn Sie das Periodensystem verwirrend und schwer zu verstehen finden, sind Sie nicht allein! Zu verstehen, wie es funktioniert, kann schwer sein, aber zu lernen, wie man es liest, wird dir helfen, in den Wissenschaften erfolgreich zu sein. Beginnen Sie damit, die Struktur des Periodensystems zu erkennen und was Sie über jedes Element erfahren. Als nächstes können Sie jedes Element studieren. Verwenden Sie abschließend die Informationen aus dem Periodensystem, um die Anzahl der Neutronen in einem Atom zu finden.
Erster Teil von Drei:
Die Struktur des Periodensystems erkennen
-
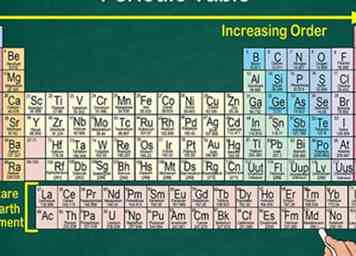 1 Lesen Sie das Periodensystem von oben links nach rechts unten. Die Elemente sind nach ihren Ordnungszahlen geordnet, die sich bei der Bewegung durch das Periodensystem erhöhen. Die Ordnungszahl gibt an, wie viele Protonen das Elementatom besitzt. Sie werden auch bemerken, dass die Atommasse jedes Elements zunimmt, wenn Sie sich über den Tisch bewegen. Dies bedeutet, dass Sie viel über das Gewicht eines Elements erkennen können, indem Sie einfach auf seinen Platz auf dem Tisch schauen.
1 Lesen Sie das Periodensystem von oben links nach rechts unten. Die Elemente sind nach ihren Ordnungszahlen geordnet, die sich bei der Bewegung durch das Periodensystem erhöhen. Die Ordnungszahl gibt an, wie viele Protonen das Elementatom besitzt. Sie werden auch bemerken, dass die Atommasse jedes Elements zunimmt, wenn Sie sich über den Tisch bewegen. Dies bedeutet, dass Sie viel über das Gewicht eines Elements erkennen können, indem Sie einfach auf seinen Platz auf dem Tisch schauen. - Die atomare Masse erhöht sich, wenn Sie sich über den Tisch bewegen, da die Masse durch Addition der Protonen und Neutronen im Atom jedes Elements berechnet wird. Die Anzahl der Protonen erhöht sich mit jedem Element, was bedeutet, dass das Gewicht ebenfalls steigt.
- Elektronen sind nicht in der Atommasse enthalten, da sie viel weniger zum Gewicht des Atoms beitragen als Protonen und Neutronen.[1]
-
 2 Beachten Sie, dass jedes Element ein weiteres Proton enthält als sein Vorgänger. Sie können dies an der Ordnungszahl erkennen. Atomare Zahlen sind von links nach rechts geordnet. Da die Elemente auch nach Gruppen angeordnet sind, sehen Sie Lücken auf dem Tisch.[2]
2 Beachten Sie, dass jedes Element ein weiteres Proton enthält als sein Vorgänger. Sie können dies an der Ordnungszahl erkennen. Atomare Zahlen sind von links nach rechts geordnet. Da die Elemente auch nach Gruppen angeordnet sind, sehen Sie Lücken auf dem Tisch.[2] - Zum Beispiel enthält die erste Reihe Wasserstoff, der eine Ordnungszahl von 1 hat, und Helium, das eine Ordnungszahl von 2 hat. Sie sind jedoch an entgegengesetzten Enden der Tabelle, da sie in verschiedenen Gruppen sind.
-
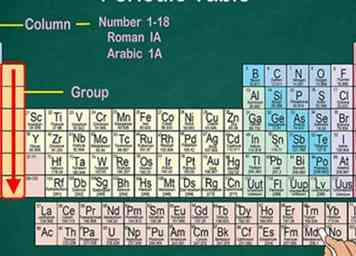 3 Erkennen Sie Gruppen, die physikalische und chemische Eigenschaften teilen. Gruppen, auch Familien genannt, fallen in eine vertikale Spalte. In den meisten Fällen haben Gruppen dieselbe Farbe. Auf diese Weise können Sie feststellen, welche Elemente ähnliche physikalische und chemische Eigenschaften aufweisen. So können Sie vorhersagen, wie sich diese Elemente verhalten.[3] Jedes Element in einer bestimmten Gruppe hat die gleiche Anzahl von Elektronen in seinem äußeren Orbital.[4]
3 Erkennen Sie Gruppen, die physikalische und chemische Eigenschaften teilen. Gruppen, auch Familien genannt, fallen in eine vertikale Spalte. In den meisten Fällen haben Gruppen dieselbe Farbe. Auf diese Weise können Sie feststellen, welche Elemente ähnliche physikalische und chemische Eigenschaften aufweisen. So können Sie vorhersagen, wie sich diese Elemente verhalten.[3] Jedes Element in einer bestimmten Gruppe hat die gleiche Anzahl von Elektronen in seinem äußeren Orbital.[4] - Die meisten Elemente fallen in 1 Gruppe, aber Wasserstoff kann mit der Halogenfamilie oder den Alkalimetallen platziert werden. In einigen Charts wird es mit beiden angezeigt.
- In den meisten Fällen werden die Spalten 1-18 über oder unter der Tabelle nummeriert. Die Zahlen können in römischen Zahlen (IA), arabischen Zahlen (1A) oder Zahlen (1) angezeigt werden.
- Wenn Sie eine Gruppe von oben nach unten gehen, heißt das "Lesen einer Gruppe".
-
 4 Beachten Sie, warum Lücken in der Tabelle vorhanden sind. Obwohl Elemente auf der Grundlage ihrer Ordnungszahl geordnet sind, sind sie auch in Gruppen und Familien angeordnet, die dieselben physikalischen und chemischen Eigenschaften aufweisen. Dies hilft Ihnen, besser zu verstehen, wie sich jedes Element verhält. Da Elemente nicht immer in Gruppierungen fallen, wenn sie an Zahl zunehmen, enthält das Periodensystem Lücken.[5]
4 Beachten Sie, warum Lücken in der Tabelle vorhanden sind. Obwohl Elemente auf der Grundlage ihrer Ordnungszahl geordnet sind, sind sie auch in Gruppen und Familien angeordnet, die dieselben physikalischen und chemischen Eigenschaften aufweisen. Dies hilft Ihnen, besser zu verstehen, wie sich jedes Element verhält. Da Elemente nicht immer in Gruppierungen fallen, wenn sie an Zahl zunehmen, enthält das Periodensystem Lücken.[5] - Zum Beispiel haben die ersten 3 Zeilen Lücken, da die Übergangsmetalle erst mit der Ordnungszahl 21 auf dem Tisch erscheinen.
- In ähnlicher Weise werden die Elemente 57 bis 102, welche die Elemente der Seltenen Erden sind, üblicherweise als eine Teilmenge in der unteren rechten Ecke der Tabelle dargestellt.
-
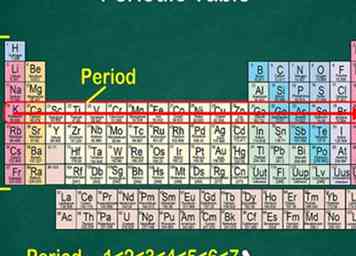 5 Beachten Sie, dass jede Zeile als Punkt bezeichnet wird. Alle Elemente in einer Periode haben die gleiche Anzahl von Atomorbitalen, wo ihre Elektronen sind. Die Anzahl der Orbitale entspricht der Anzahl der Perioden. Es gibt 7 Zeilen, was bedeutet, dass es 7 Perioden gibt.[6]
5 Beachten Sie, dass jede Zeile als Punkt bezeichnet wird. Alle Elemente in einer Periode haben die gleiche Anzahl von Atomorbitalen, wo ihre Elektronen sind. Die Anzahl der Orbitale entspricht der Anzahl der Perioden. Es gibt 7 Zeilen, was bedeutet, dass es 7 Perioden gibt.[6] - Zum Beispiel haben die Elemente in der Periode 1 1 Orbital, während die Elemente in Periode 7 7 Orbitale haben.
- In den meisten Fällen sind sie von 1 bis 7 auf der linken Seite des Tisches nummeriert.
- Wenn Sie sich von links nach rechts über eine Zeile bewegen, wird dies als "Lesen über einen Punkt" bezeichnet.
-
 6 Unterscheide zwischen Metallen, Halbmetallen und Nichtmetallen. Sie können die Eigenschaften eines Elements besser verstehen, indem Sie erkennen, um welchen Elementtyp es sich handelt. Glücklicherweise verwenden die meisten periodischen Tabellen Farbe, um anzuzeigen, ob das Element ein Metall, ein Halbmetall oder ein Nichtmetall ist. Sie werden feststellen, dass Metalle auf der linken Seite des Tisches erscheinen, während Nicht-Metalle auf der rechten Seite fallen. Halbmetalle sind zwischen ihnen eingeschlossen.[7]
6 Unterscheide zwischen Metallen, Halbmetallen und Nichtmetallen. Sie können die Eigenschaften eines Elements besser verstehen, indem Sie erkennen, um welchen Elementtyp es sich handelt. Glücklicherweise verwenden die meisten periodischen Tabellen Farbe, um anzuzeigen, ob das Element ein Metall, ein Halbmetall oder ein Nichtmetall ist. Sie werden feststellen, dass Metalle auf der linken Seite des Tisches erscheinen, während Nicht-Metalle auf der rechten Seite fallen. Halbmetalle sind zwischen ihnen eingeschlossen.[7] - Denken Sie daran, dass Wasserstoff aufgrund seiner Eigenschaften entweder mit den Halogenen oder den Alkalimetallen gruppiert werden kann, so dass er auf jeder Seite des Tisches erscheinen kann oder anders gefärbt sein kann.
- Elemente werden als Metall bezeichnet, wenn sie einen Glanz aufweisen, bei Raumtemperatur fest sind, Wärme und Elektrizität leiten und verformbar und duktil sind.
- Elemente gelten als Nichtmetall, wenn sie keinen Glanz haben, keine Wärme oder Elektrizität leiten und nicht verformbar sind. Diese Elemente sind normalerweise Gase bei Raumtemperatur, können aber auch bei bestimmten Temperaturen fest oder flüssig werden.
- Elemente werden als Halbmetalle bezeichnet, wenn sie eine Mischung von Eigenschaften von Metallen und Nichtmetallen aufweisen.[8]
Zweiter Teil von Drei:
Die Elemente studieren
-
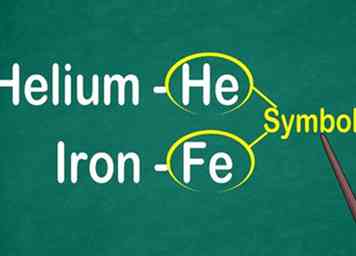 1 Erkenne das 1 bis 2-stellige Symbol des Elements. Es erscheint meistens in der Mitte der Box in einer großen Schrift. Das Symbol verkürzt den Namen des Elements, der in verschiedenen Sprachen standardisiert ist. Wenn Sie experimentieren oder mit elementaren Gleichungen arbeiten, werden Sie wahrscheinlich die Symbole der Elemente verwenden, daher ist es wichtig, sich mit ihnen vertraut zu machen.[9]
1 Erkenne das 1 bis 2-stellige Symbol des Elements. Es erscheint meistens in der Mitte der Box in einer großen Schrift. Das Symbol verkürzt den Namen des Elements, der in verschiedenen Sprachen standardisiert ist. Wenn Sie experimentieren oder mit elementaren Gleichungen arbeiten, werden Sie wahrscheinlich die Symbole der Elemente verwenden, daher ist es wichtig, sich mit ihnen vertraut zu machen.[9] - Dieses Symbol wird normalerweise von der lateinischen Form des Elementnamens abgeleitet, aber es kann von dem allgemein akzeptierten gebräuchlichen Namen abgeleitet werden, besonders für neuere Elemente. Zum Beispiel ist das Symbol für Helium He, das dem gebräuchlichen Namen sehr ähnlich ist. Das Symbol für Eisen ist jedoch Fe, was zunächst schwieriger zu erkennen ist.
-
 2 Suchen Sie nach dem vollständigen Namen des Elements, sofern es vorhanden ist. Dies ist der Name des Elements, das Sie beim Schreiben verwenden werden. Zum Beispiel sind "Helium" und "Carbon" die Namen von Elementen. In den meisten Fällen wird dies direkt unter dem Symbol angezeigt, aber die Platzierung kann variieren.[10]
2 Suchen Sie nach dem vollständigen Namen des Elements, sofern es vorhanden ist. Dies ist der Name des Elements, das Sie beim Schreiben verwenden werden. Zum Beispiel sind "Helium" und "Carbon" die Namen von Elementen. In den meisten Fällen wird dies direkt unter dem Symbol angezeigt, aber die Platzierung kann variieren.[10] - In einigen periodischen Tabellen kann der vollständige Name weggelassen werden, indem nur das Symbol verwendet wird.
-
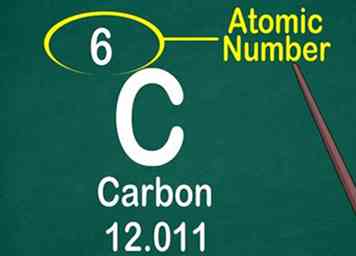 3 Finde die Ordnungszahl. Die Ordnungszahl befindet sich oft oben in der Box, entweder in der Mitte oder in der Ecke. Es könnte sich jedoch unter dem Elementsymbol oder dem Namen befinden. Atomzahlen laufen sequentiell von 1-118.[11]
3 Finde die Ordnungszahl. Die Ordnungszahl befindet sich oft oben in der Box, entweder in der Mitte oder in der Ecke. Es könnte sich jedoch unter dem Elementsymbol oder dem Namen befinden. Atomzahlen laufen sequentiell von 1-118.[11] - Die Ordnungszahl ist eine ganze Zahl, keine Dezimalzahl.
-
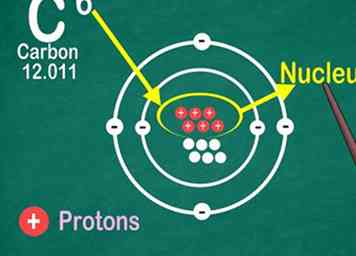 4 Erkenne die Ordnungszahl ist die Anzahl der Protonen in einem Atom. Alle Atome eines Elements enthalten die gleiche Anzahl von Protonen. Im Gegensatz zu Elektronen kann ein Atom keine Protonen gewinnen oder verlieren. Sonst würde sich das Element ändern![12]
4 Erkenne die Ordnungszahl ist die Anzahl der Protonen in einem Atom. Alle Atome eines Elements enthalten die gleiche Anzahl von Protonen. Im Gegensatz zu Elektronen kann ein Atom keine Protonen gewinnen oder verlieren. Sonst würde sich das Element ändern![12] - Sie werden die Ordnungszahl verwenden, um auch die Anzahl der Elektronen und Neutronen zu finden!
-
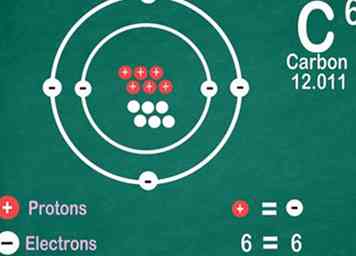 5 Wissenselemente enthalten die gleiche Anzahl von Elektronen wie Protonen. Es gibt eine Ausnahme, wenn sie ionisiert sind. Protonen haben eine positive Ladung, und Elektronen haben eine negative Ladung. Da reguläre Atome keine elektrische Ladung haben, sind Elektronen und Protonen gleich. Ein Atom kann jedoch Elektronen verlieren oder aufnehmen, wodurch es ionisiert wird.[13]
5 Wissenselemente enthalten die gleiche Anzahl von Elektronen wie Protonen. Es gibt eine Ausnahme, wenn sie ionisiert sind. Protonen haben eine positive Ladung, und Elektronen haben eine negative Ladung. Da reguläre Atome keine elektrische Ladung haben, sind Elektronen und Protonen gleich. Ein Atom kann jedoch Elektronen verlieren oder aufnehmen, wodurch es ionisiert wird.[13] - Ionen sind elektrisch geladen. Wenn ein Ion mehr Protonen hat, ist es positiv, was mit einem positiven Vorzeichen neben dem Ionensymbol angezeigt wird. Wenn es mehr Elektronen hat, ist das Ion negativ, was mit einem negativen Symbol angezeigt wird.
- Wenn das Element kein Ion ist, wird kein Plus- oder Minuszeichen angezeigt.
Teil drei von drei:
Verwenden des Atomgewichts zur Berechnung von Neutronen
-
 1 Finde das Atomgewicht. Das Atomgewicht erscheint normalerweise am unteren Rand der Box unterhalb des Elementsymbols. Das Atomgewicht repräsentiert das kombinierte Gewicht der Teilchen im Kern, zu denen Protonen und Neutronen gehören. Ionen erschweren jedoch die Berechnung, so dass das Atomgewicht einen Durchschnitt der atomaren Masse des Elements und der atomaren Masse seiner Ionen darstellt.[14]
1 Finde das Atomgewicht. Das Atomgewicht erscheint normalerweise am unteren Rand der Box unterhalb des Elementsymbols. Das Atomgewicht repräsentiert das kombinierte Gewicht der Teilchen im Kern, zu denen Protonen und Neutronen gehören. Ionen erschweren jedoch die Berechnung, so dass das Atomgewicht einen Durchschnitt der atomaren Masse des Elements und der atomaren Masse seiner Ionen darstellt.[14] - Da die Gewichte gemittelt werden, haben die meisten Elemente Atomgewichte, die Dezimalzahlen enthalten.
- Obwohl es so aussehen mag, als ob das Atomgewicht von links oben nach rechts unten ansteigt, trifft dies nicht in allen Fällen zu.
- 2 Bestimmen Sie die Massenzahl des Elements, das Sie studieren. Sie können die Massenzahl finden, indem Sie die Atommasse auf die nächste ganze Zahl runden. Dies erklärt die Tatsache, dass das Atomgewicht ein Durchschnitt aller möglichen atomaren Massen für dieses Element einschließlich Ionen ist.[15]
- Zum Beispiel ist das Atomgewicht von Kohlenstoff 12,011, was auf 12 Runden geht. Ähnlich ist das Gewicht von Eisen 55,847, was auf 56 Runden zählt.
-
 3 Subtrahiere die Ordnungszahl von der Massenzahl, um die Neutronen zu finden. Die Massenzahl wird berechnet, indem die Anzahl der Protonen und Neutronen addiert wird. Dadurch können Sie die Anzahl der Neutronen in einem Atom leicht finden, indem Sie die Anzahl oder Protonen von der Massenzahl subtrahieren![16]
3 Subtrahiere die Ordnungszahl von der Massenzahl, um die Neutronen zu finden. Die Massenzahl wird berechnet, indem die Anzahl der Protonen und Neutronen addiert wird. Dadurch können Sie die Anzahl der Neutronen in einem Atom leicht finden, indem Sie die Anzahl oder Protonen von der Massenzahl subtrahieren![16] - Verwenden Sie diese Formel: Neutronen = Massenzahl - Protonen
- Zum Beispiel ist Carbon's Massenzahl 12 und es hat 6 Protonen. Seit 12 - 6 = 6 wissen Sie, dass Kohlenstoff 6 Neutronen hat.
- Für ein anderes Beispiel ist die Massenzahl von Eisen 56 und hat 26 Protonen. Seit 56 - 26 = 30 wissen Sie, dass Eisen 30 Neutronen hat.
- Die Isotope eines Atoms enthalten eine unterschiedliche Anzahl von Neutronen, wodurch sich das Atomgewicht ändert.
Periodensystem der Probe
 Periodensystem der Probe
Periodensystem der Probe
Facebook
Twitter
Google+
 Minotauromaquia
Minotauromaquia
 1 Lesen Sie das Periodensystem von oben links nach rechts unten. Die Elemente sind nach ihren Ordnungszahlen geordnet, die sich bei der Bewegung durch das Periodensystem erhöhen. Die Ordnungszahl gibt an, wie viele Protonen das Elementatom besitzt. Sie werden auch bemerken, dass die Atommasse jedes Elements zunimmt, wenn Sie sich über den Tisch bewegen. Dies bedeutet, dass Sie viel über das Gewicht eines Elements erkennen können, indem Sie einfach auf seinen Platz auf dem Tisch schauen.
1 Lesen Sie das Periodensystem von oben links nach rechts unten. Die Elemente sind nach ihren Ordnungszahlen geordnet, die sich bei der Bewegung durch das Periodensystem erhöhen. Die Ordnungszahl gibt an, wie viele Protonen das Elementatom besitzt. Sie werden auch bemerken, dass die Atommasse jedes Elements zunimmt, wenn Sie sich über den Tisch bewegen. Dies bedeutet, dass Sie viel über das Gewicht eines Elements erkennen können, indem Sie einfach auf seinen Platz auf dem Tisch schauen.  3 Erkennen Sie Gruppen, die physikalische und chemische Eigenschaften teilen. Gruppen, auch Familien genannt, fallen in eine vertikale Spalte. In den meisten Fällen haben Gruppen dieselbe Farbe. Auf diese Weise können Sie feststellen, welche Elemente ähnliche physikalische und chemische Eigenschaften aufweisen. So können Sie vorhersagen, wie sich diese Elemente verhalten.[3] Jedes Element in einer bestimmten Gruppe hat die gleiche Anzahl von Elektronen in seinem äußeren Orbital.[4]
3 Erkennen Sie Gruppen, die physikalische und chemische Eigenschaften teilen. Gruppen, auch Familien genannt, fallen in eine vertikale Spalte. In den meisten Fällen haben Gruppen dieselbe Farbe. Auf diese Weise können Sie feststellen, welche Elemente ähnliche physikalische und chemische Eigenschaften aufweisen. So können Sie vorhersagen, wie sich diese Elemente verhalten.[3] Jedes Element in einer bestimmten Gruppe hat die gleiche Anzahl von Elektronen in seinem äußeren Orbital.[4]  5 Beachten Sie, dass jede Zeile als Punkt bezeichnet wird. Alle Elemente in einer Periode haben die gleiche Anzahl von Atomorbitalen, wo ihre Elektronen sind. Die Anzahl der Orbitale entspricht der Anzahl der Perioden. Es gibt 7 Zeilen, was bedeutet, dass es 7 Perioden gibt.[6]
5 Beachten Sie, dass jede Zeile als Punkt bezeichnet wird. Alle Elemente in einer Periode haben die gleiche Anzahl von Atomorbitalen, wo ihre Elektronen sind. Die Anzahl der Orbitale entspricht der Anzahl der Perioden. Es gibt 7 Zeilen, was bedeutet, dass es 7 Perioden gibt.[6]  6 Unterscheide zwischen Metallen, Halbmetallen und Nichtmetallen. Sie können die Eigenschaften eines Elements besser verstehen, indem Sie erkennen, um welchen Elementtyp es sich handelt. Glücklicherweise verwenden die meisten periodischen Tabellen Farbe, um anzuzeigen, ob das Element ein Metall, ein Halbmetall oder ein Nichtmetall ist. Sie werden feststellen, dass Metalle auf der linken Seite des Tisches erscheinen, während Nicht-Metalle auf der rechten Seite fallen. Halbmetalle sind zwischen ihnen eingeschlossen.[7]
6 Unterscheide zwischen Metallen, Halbmetallen und Nichtmetallen. Sie können die Eigenschaften eines Elements besser verstehen, indem Sie erkennen, um welchen Elementtyp es sich handelt. Glücklicherweise verwenden die meisten periodischen Tabellen Farbe, um anzuzeigen, ob das Element ein Metall, ein Halbmetall oder ein Nichtmetall ist. Sie werden feststellen, dass Metalle auf der linken Seite des Tisches erscheinen, während Nicht-Metalle auf der rechten Seite fallen. Halbmetalle sind zwischen ihnen eingeschlossen.[7] 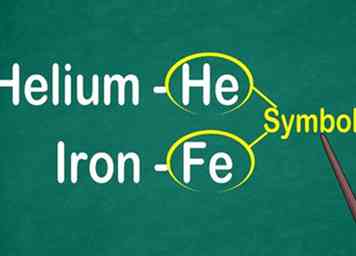 1 Erkenne das 1 bis 2-stellige Symbol des Elements. Es erscheint meistens in der Mitte der Box in einer großen Schrift. Das Symbol verkürzt den Namen des Elements, der in verschiedenen Sprachen standardisiert ist. Wenn Sie experimentieren oder mit elementaren Gleichungen arbeiten, werden Sie wahrscheinlich die Symbole der Elemente verwenden, daher ist es wichtig, sich mit ihnen vertraut zu machen.[9]
1 Erkenne das 1 bis 2-stellige Symbol des Elements. Es erscheint meistens in der Mitte der Box in einer großen Schrift. Das Symbol verkürzt den Namen des Elements, der in verschiedenen Sprachen standardisiert ist. Wenn Sie experimentieren oder mit elementaren Gleichungen arbeiten, werden Sie wahrscheinlich die Symbole der Elemente verwenden, daher ist es wichtig, sich mit ihnen vertraut zu machen.[9]  2 Suchen Sie nach dem vollständigen Namen des Elements, sofern es vorhanden ist. Dies ist der Name des Elements, das Sie beim Schreiben verwenden werden. Zum Beispiel sind "Helium" und "Carbon" die Namen von Elementen. In den meisten Fällen wird dies direkt unter dem Symbol angezeigt, aber die Platzierung kann variieren.[10]
2 Suchen Sie nach dem vollständigen Namen des Elements, sofern es vorhanden ist. Dies ist der Name des Elements, das Sie beim Schreiben verwenden werden. Zum Beispiel sind "Helium" und "Carbon" die Namen von Elementen. In den meisten Fällen wird dies direkt unter dem Symbol angezeigt, aber die Platzierung kann variieren.[10]  3 Finde die Ordnungszahl. Die Ordnungszahl befindet sich oft oben in der Box, entweder in der Mitte oder in der Ecke. Es könnte sich jedoch unter dem Elementsymbol oder dem Namen befinden. Atomzahlen laufen sequentiell von 1-118.[11]
3 Finde die Ordnungszahl. Die Ordnungszahl befindet sich oft oben in der Box, entweder in der Mitte oder in der Ecke. Es könnte sich jedoch unter dem Elementsymbol oder dem Namen befinden. Atomzahlen laufen sequentiell von 1-118.[11]  4 Erkenne die Ordnungszahl ist die Anzahl der Protonen in einem Atom. Alle Atome eines Elements enthalten die gleiche Anzahl von Protonen. Im Gegensatz zu Elektronen kann ein Atom keine Protonen gewinnen oder verlieren. Sonst würde sich das Element ändern![12]
4 Erkenne die Ordnungszahl ist die Anzahl der Protonen in einem Atom. Alle Atome eines Elements enthalten die gleiche Anzahl von Protonen. Im Gegensatz zu Elektronen kann ein Atom keine Protonen gewinnen oder verlieren. Sonst würde sich das Element ändern![12]  5 Wissenselemente enthalten die gleiche Anzahl von Elektronen wie Protonen. Es gibt eine Ausnahme, wenn sie ionisiert sind. Protonen haben eine positive Ladung, und Elektronen haben eine negative Ladung. Da reguläre Atome keine elektrische Ladung haben, sind Elektronen und Protonen gleich. Ein Atom kann jedoch Elektronen verlieren oder aufnehmen, wodurch es ionisiert wird.[13]
5 Wissenselemente enthalten die gleiche Anzahl von Elektronen wie Protonen. Es gibt eine Ausnahme, wenn sie ionisiert sind. Protonen haben eine positive Ladung, und Elektronen haben eine negative Ladung. Da reguläre Atome keine elektrische Ladung haben, sind Elektronen und Protonen gleich. Ein Atom kann jedoch Elektronen verlieren oder aufnehmen, wodurch es ionisiert wird.[13]  1 Finde das Atomgewicht. Das Atomgewicht erscheint normalerweise am unteren Rand der Box unterhalb des Elementsymbols. Das Atomgewicht repräsentiert das kombinierte Gewicht der Teilchen im Kern, zu denen Protonen und Neutronen gehören. Ionen erschweren jedoch die Berechnung, so dass das Atomgewicht einen Durchschnitt der atomaren Masse des Elements und der atomaren Masse seiner Ionen darstellt.[14]
1 Finde das Atomgewicht. Das Atomgewicht erscheint normalerweise am unteren Rand der Box unterhalb des Elementsymbols. Das Atomgewicht repräsentiert das kombinierte Gewicht der Teilchen im Kern, zu denen Protonen und Neutronen gehören. Ionen erschweren jedoch die Berechnung, so dass das Atomgewicht einen Durchschnitt der atomaren Masse des Elements und der atomaren Masse seiner Ionen darstellt.[14]  3 Subtrahiere die Ordnungszahl von der Massenzahl, um die Neutronen zu finden. Die Massenzahl wird berechnet, indem die Anzahl der Protonen und Neutronen addiert wird. Dadurch können Sie die Anzahl der Neutronen in einem Atom leicht finden, indem Sie die Anzahl oder Protonen von der Massenzahl subtrahieren![16]
3 Subtrahiere die Ordnungszahl von der Massenzahl, um die Neutronen zu finden. Die Massenzahl wird berechnet, indem die Anzahl der Protonen und Neutronen addiert wird. Dadurch können Sie die Anzahl der Neutronen in einem Atom leicht finden, indem Sie die Anzahl oder Protonen von der Massenzahl subtrahieren![16]